-
室温下,下列溶液中粒子浓度关系正确的是( )
A. Na2S溶液:c(Na+)>c(HS-)>c(OH-)>c(H2S)
B. Na2C2O4溶液中:c(OH-)=c(H+)+c(HC2O4-)+2c(H2C2O4)
C. Na2CO3溶液:c(Na+)+c(H+)=2c(CO32-)+c(OH-)
D. CH3COONa和CaCl2混合溶液:c(Na+)+c(Ca2+)=c(CH3COO-)+c(CH3COOH)+2c(Cl-)
难度: 困难查看答案及解析
-
判断强弱电解质的标准是( )
A. 导电能力 B. 相对分子质量 C. 电离程度 D. 溶解度
难度: 中等查看答案及解析
-
北魏贾思勰《齐民要术·作酢法》这样描述苦酒:“乌梅苦酒法:乌梅去核,一升许肉,以五升苦酒渍数日,曝干,捣作屑。欲食,辄投水中,即成醋尔。”下列有关苦酒主要成分的说法正确的是( )
A. 苦酒的主要溶质是非电解质 B. 苦酒的主要溶质是强电解质
C. 苦酒的主要溶质是弱电解质 D. 苦酒的溶液中只存在分子,不存在离子
难度: 简单查看答案及解析
-
氢氰酸(HCN)的下列性质中,不能说明它是弱电解质的是( )
A. 1 mol·L-1氢氰酸溶液的pH约为3
B. 同浓度的盐酸比HCN溶液导电性强
C. 同浓度同体积的HCN溶液和NaOH溶液混合,溶液呈碱性
D. 10 mL 1 mol·L-1HCN恰好与10 mL 1 mol·L-1 NaOH溶液完全反应
难度: 简单查看答案及解析
-
下列四种溶液中,水的电离程度最大的是( )
A. pH=5的NH4Cl溶液 B. pH=5的NaHSO4溶液
C. pH=8的CH3COONa溶液 D. pH=8的NaOH溶液
难度: 中等查看答案及解析
-
已知25 ℃下,醋酸溶液中存在下述关系:K=c(H+)c(CH3COO-)/c(CH3COOH)=1.75×10-5,其中K的数值是该温度下醋酸的电离平衡常数。有关K的下列说法正确的是( )
A. 当向该溶液中加入一定量的硫酸时,K值增大
B. 升高温度,K值增大
C. 向醋酸溶液中加水,K值增大
D. 向醋酸溶液中加醋酸钠,K值减小
难度: 中等查看答案及解析
-
下列有关盐类水解的叙述中正确的是( )
A. 溶液呈中性的盐一定是强酸、强碱生成的盐
B. 含有弱酸根盐的水溶液一定呈碱性
C. 盐溶液的酸碱性主要决定于形成盐的酸和碱的相对强弱
D. 强酸强碱盐的水溶液一定呈中性
难度: 中等查看答案及解析
-
稀氨水中存在着下列平衡:NH3·H2O
NH4++OH-,若要使平衡向逆反应方向移动,同时使c(OH-)增大,应加入的物质或采取的措施是( )
①NH4Cl固体 ②硫酸 ③NaOH固体 ④水 ⑤加热 ⑥少量MgSO4固体
A. ①②③⑤ B. ③ C. ③④⑥ D. ③⑤
难度: 简单查看答案及解析
-
室温下,向10 mL 0.1 mol/L醋酸溶液中加水稀释后,下列说法正确的是( )
A. 溶液中离子的数目减小
B. 再加入CH3COONa固体能促进醋酸的电离
C. 醋酸的电离程度增大,c(H+)亦增大
D. 溶液中c(CH3COO-)/c(CH3COOH)∙c(OH-)不变
难度: 中等查看答案及解析
-
已知在100 ℃时水的离子积Kw=1×10-12,下列溶液的温度均为100 ℃。其中说法正确的是( )
A. 0.005 mol·L-1的H2SO4溶液,pH=2
B. 0.001 mol·L-1的NaOH溶液,pH=11
C. 0.005 mol·L-1的H2SO4溶液与0.01 mol·L-1的NaOH溶液等体积混合,混合溶液的pH为6,溶液显酸性
D. pH=3的H2SO4溶液与pH=9的NaOH溶液完全中和需要NaOH溶液的体积是硫酸溶液的2倍
难度: 中等查看答案及解析
-
用标准盐酸滴定未知浓度的NaOH溶液,下列各操作中,会引起实验误差的是( )
A. 取干燥洁净的酸式滴定管立即装入标准盐酸
B. 用蒸馏水洗净锥形瓶后,立即装入一定体积的NaOH溶液后进行滴定
C. 往盛有20.00 mL NaOH溶液的锥形瓶中,滴入几滴酚酞指示剂后进行滴定
D. 用蒸馏水洗净锥形瓶后,再用NaOH溶液润洗,然后装入一定体积的NaOH溶液
难度: 中等查看答案及解析
-
下列说法中错误的是( )
A. 0.1 mol/L的HCl与0.1 mol/L的NH3·H2O等体积混合,溶液中的c(NH4+)>c(Cl-)
B. 常温下pH=3的HCl与pH=11的氨水等体积混合,溶液中的c(OH-)>c(H+)
C. pH=11的NaCN溶液中,由水电离出来的c(OH-)=c(H+)
D. CO2、SO2的水溶液能导电,但它们是非电解质
难度: 中等查看答案及解析
-
下列各组数据中,前者一定比后者大的是
A. 相同温度下,pH=10的KOH溶液和pH=10的K2CO3溶液由水电离出的OH-浓度
B. 0.1 mol·L-1(NH4)2SO4溶液与0.1 mol·L-1(NH4)2CO3溶液中NH浓度
C. Na2CO3溶液中HCO3-和OH-的浓度
D. 纯水在80℃的pH和在常温下的pH
难度: 中等查看答案及解析
-
如下图所示的八个装置中,属于原电池的是( )
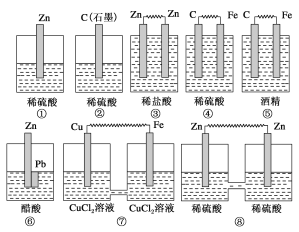
A. 全部 B. ④⑥⑦ C. ③④⑤⑥⑦⑧ D. 除①②③外
难度: 简单查看答案及解析
-
在常温时,将a1 mL b1 mol·L-1CH3COOH溶液加入到a2 mL b2 mol·L-1 NaOH溶液中,下列结论正确的是( )
A. 如果a1=a2、b1=b2,则混合溶液中c(CH3COO-)=c(Na+)
B. 如果混合溶液的pH=7,则混合溶液中c(CH3COO-)>c(Na+)
C. 如果混合溶液的pH<7,则a1b1=a2b2
D. 如果a1=a2,且混合溶液的pH<7,则b1>b2
难度: 困难查看答案及解析
-
今有室温下四种溶液,下列有关叙述不正确的是( )

A. ③和④中分别加入适量的醋酸钠晶体后,两溶液的pH均增大
B. ②和③两溶液等体积混合,所得溶液中c(H+)>c(OH-)
C. 分别加水稀释10倍,四种溶液的pH:①>②>④>③
D. V1 L ④与V2L ①溶液混合后,若混合后溶液pH=7,则V1<V2
难度: 困难查看答案及解析
-
同物质的量浓度、同体积的HCl和醋酸溶液,分别与过量相同情况的Na2CO3固体反应时,下列叙述正确的是( )
A. 反应速率HCl>CH3COOH
B. 气泡逸出速率CH3COOH>HCl
C. 在相同条件下两酸产生的CO2的体积不相同
D. 如果两酸的c(H+)相同时,两酸的物质的量浓度HCl>CH3COOH
难度: 中等查看答案及解析
-
下列混合溶液中,各离子浓度的大小顺序正确的是( )
A. 10 mL 0.1 mol/L氨水与10 mL 0.1 mol/L盐酸混合:c(Cl-)>c(NH4+)>c(OH-)>c(H+)
B. 10 mL 0.1 mol/L NH4Cl溶液与5 mL 0.2 mol/L NaOH溶液混合:c(Na+)=c(Cl-)>c(OH-)>c(H+)
C. 10 mL 0.1 mol/L CH3COOH溶液与5 mL 0.2 mol/L NaOH溶液混合:c(Na+)=c(CH3COO-)>c(OH-)>c(H+)
D. 10 mL 0.5 mol/L CH3COONa溶液与6 mL 1 mol/L盐酸混合:c(Cl-)>c(Na+)>c(OH-)>c(H+)
难度: 困难查看答案及解析
-
已知:某温度下,Ksp[Ca(OH)2]=5.5×10-6、Ksp[Mg(OH)2]=1.8×10-11、Ksp(AgCl)=1.8×10-10。相同条件下,在这三种物质的饱和溶液中,有关金属离子浓度的说法正确的是( )
A. Mg2+的浓度最小
B. Ca2+的浓度最小
C. Ag+的浓度最小
D. 同一温度下,难溶电解质的Ksp越大,溶液中的金属离子的浓度也越大
难度: 中等查看答案及解析
-
25 ℃时,浓度均为0.1 mol/L的HA溶液和BOH溶液,pH分别是1和11。下列说法正确的是( )
A. BOH溶于水,其电离方程式是BOH===B++OH-
B. 若一定量的上述两溶液混合后pH=7,则c(A-)=c(B+)
C. 在0.1 mol/L BA溶液中,c(B+)>c(A-)>c(OH-)>c(H+)
D. 若将0.1 mol/L BOH溶液稀释至0.001 mol/L,则溶液的pH=9
难度: 中等查看答案及解析
-
常温下,0.2 mol·L-1的一元酸HA与等浓度的NaOH溶液等体积混合后,所得溶液中部分微粒组分及浓度如图所示,下列说法正确的是( )
A. HA为强酸
B. 该混合液pH=7
C. 该混合溶液中:c(A-)+c(Y)=c(Na+)
D. 图中X表示HA,Y表示OH-,Z表示H+
难度: 中等查看答案及解析
-
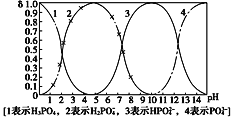
下表是几种弱酸常温下的电离平衡常数:
CH3COOH
H2CO3
H2S
H3PO4
1.8×10-5
K1=4.3×10-7
K2=5.6×10-11
K1=9.1×10-8
K2=1.1×10-12
K1=7.5×10-3
K2=6.2×10-8
K3=2.2×10-13
则下列说法中不正确的是( )
A. 碳酸的酸性强于氢硫酸
B. 多元弱酸的酸性主要由第一步电离决定
C. 常温下,加水稀释醋酸,c(CH3COO-)/c(CH3COOH)∙c(OH-)增大
D. 向弱酸溶液中加少量NaOH溶液,电离常数不变
难度: 困难查看答案及解析
-
pH=2的两种一元酸x和y,体积均为100 mL,稀释过程中pH与溶液体积的关系如图所示。分别滴加NaOH溶液(c=0.1 mol·L-1)至pH=7,消耗NaOH溶液的体积为Vx、Vy,则( )
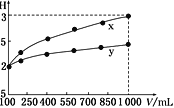
A. x为弱酸,Vx<Vy B. x为强酸,Vx>Vy
C. y为弱酸,Vx<Vy D. y为强酸,Vx>Vy
难度: 困难查看答案及解析
-
298 K时,在20.0 mL 0.10mol·L-1氨水中滴入0.10mol·L-1的盐酸,溶液的pH与所加盐酸的体积关系如图所示。已知0.10 mol·L-1 氨水的电离度为1.32%,下列有关叙述正确的是

A. 该滴定过程应该选择酚酞作为指示剂
B. M点对应的盐酸体积为20.0 mL
C. M点处的溶液中c(NH4+)=c(Cl-)=c(H+)=c(OH-)
D. N点处的溶液中pH<12
难度: 中等查看答案及解析
-
常温下将NaOH溶液滴加到己二酸(H2X)溶液中,混合溶液的pH与离子浓度变化的关系如图所示。下列叙述错误的是
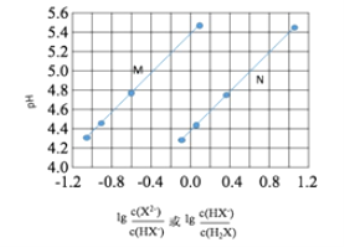
A. Ka2(H2X)的数量级为10–6
B. 曲线N表示pH与
的变化关系
C. NaHX溶液中c(H+)>c(OH-)
D. 当混合溶液呈中性时,c(Na+)>c(HX-)>c(X2-)>c(OH-)=c(H+)
难度: 困难查看答案及解析