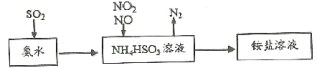
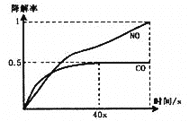
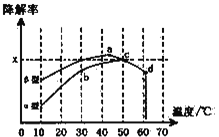
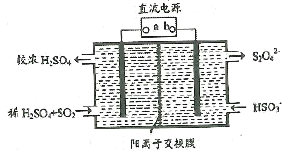
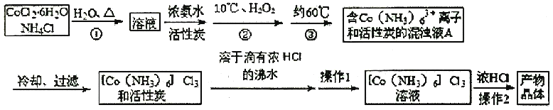
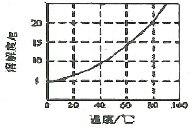
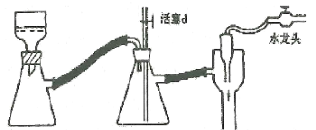
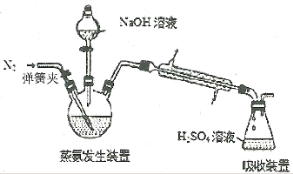
-
2019年地球日活动主题为“珍惜地球资源,转变发展方式——提高资源利用效益”,下列说法不正确的是( )
A.利用太阳能、风能和氢能替代化石能源能改善空气质量
B.利用二氧化碳等原料合成的可降解塑料替代聚乙烯塑料,可减少“白色污染”
C.生物质能在未来可以替代其他的能源物质,通过生物化学转换、热化学转换等方式为人们的生活生产提供能量来源
D.从根本上解决环境、生态问题要依靠绿色化学的发展,核心是应用化学原理对环境污染进行全面治理
难度: 中等查看答案及解析
-
下列化学用语表示正确的是( )
A.HF的电子式:
B.乙醛的最简式:C2H4O
C.CCl4的球棍模型
D.硫离子结构示意图:
难度: 简单查看答案及解析
-
下列说法不正确的是( )
A.硫酸铜是常用的游泳池水消毒剂,也可用于饮用水的消毒
B.氯化铁溶液与铜反应可用于制作印刷电路板
C.利用高纯硅可以制成光电池,将光能直接转化为电能
D.纯碱是一种重要的化工原料,广泛应用于玻璃、肥皂、造纸、食品等工业
难度: 简单查看答案及解析
-
常温下,下列各组离子在指定溶液中能大量共存的是( )
A.无色透明的溶液中:K+、Cr2O72-、Cl-、H+
B.
=1×1012的溶液中:K+、Na+、CO32-、NO3-
C.c(SO32-)=0.1mol·L-1的溶液中:Na+、Cl-、H+、Ca2+
D.使pH试纸变红的溶液中:NH4+、Al3+、SO42-、Cl-
难度: 中等查看答案及解析
-
2019年是门捷列夫提出元素周期表150周年。根据元素周期律和元素周期表,下列推断不合理的是( )
A.C的非金属性强于Si,CH4的沸点高于SiH4
B.
与
得电子能力相同
C.短周期元素中原子半径最大的为Na
D.同族元素的原子化学性质相似,同族元素原子间可能形成离子化合物
难度: 简单查看答案及解析
-
下列说法正确的是( )
A.按系统命名法:CH3CH(C2H5)CH(CH3)2的正确名称:2-甲基-3-乙基丁烷
B.某有机分子结构是:
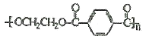 ,其单体可能是乙二醇和对苯二甲酸
,其单体可能是乙二醇和对苯二甲酸C.等质量的乳酸(C3H6O3)和葡萄糖分别完全燃烧,后者消耗氧气的物质的量多
D.有机物
一定条件下与H2进行1:1加成反应,产物共有3种
难度: 中等查看答案及解析
-
锂-空气电池的装置示意图如下,以金属锂作电极,从空气中获得O2。下列说法正确的是( )

A.锂作负极,电极反应式为:Li-e-+OH-=LiOH
B.若隔膜被腐蚀,不会影响该电池正常使用
C.多孔碳电极上发生的电极反应为:O2+2H2O+4e-=4OH-
D.应用该电池电镀铜,若析出64g Cu,理论上消耗22.4L O2
难度: 困难查看答案及解析
-
在容积可变的密闭容器中充入2mol苯蒸气和4mol氢气,恒温T1和恒压P1条件下进行如下反应:
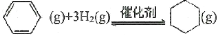 △H1= -208.8kJ· mol-1,达平衡时容器的体积为2L,苯的转化率为50%。下列有关说法正确的是( )
△H1= -208.8kJ· mol-1,达平衡时容器的体积为2L,苯的转化率为50%。下列有关说法正确的是( )A.苯蒸气的体积分数不再变化时,说明该反应己达平衡状态
B.反应体系中气体总浓度保持不变,说明该反应己达平衡状态
C.在原平衡基础上,再向容器中充入3mol苯蒸气,平衡逆向移动
D.在原平衡基础上,升高温度,苯的转化率增大
难度: 困难查看答案及解析
-
下列说法正确的是( )
A.往海带灰的浸泡液中加入过量的氯水,保证I-完全氧化为I2
B.在食醋总酸含量的测定中,没有控制好滴定终点,溶液显深红色,则必须重做实验
C.淀粉在稀硫酸催化作用下水解,向水解液中加入银氨溶液,加热后出现银镜
D.硝基苯制备实验中,将温度计插入水浴,但水银球不能接触烧杯底部和烧杯壁
难度: 简单查看答案及解析
-
下列有关化学推理的叙述正确的是( )
A.根据溶液导电性强弱可将化合物分为强电解质和弱电解质
B.向饱和Na2CO3溶液中通入足量的CO2,溶液变浑浊,由此证明了NaHCO3溶解度比Na2CO3大
C.常温下,将CH3COONa溶液和稀盐酸混合至溶液pH=7时:c(Cl-)=c(CH3COOH)
D.若向Ca(ClO)2溶液中通入少量CO2可得CaCO3,则通入少量SO2可得CaSO3
难度: 简单查看答案及解析
-
用NA表示阿伏加德罗常数的值。下列判断正确的是( )
A.0.1mol H2和0.1mol I2在密闭容器中充分反应后,其分子总数为0.2NA
B.30g乙烷(C2H6)含有共价键总数为6NA
C.1L 1mol·L-1的(NH4)2SO4溶液中含有的NH4+数目为2NA
D.常温下,将2.7g铝片投入过量浓硝酸中充分反应转移电子数为0.3NA
难度: 中等查看答案及解析
-
下列说法正确的是( )
A.PCl3、Cl2O、SF2分子中各原子最外层都具有8电子稳定结构
B.H2O分子比H2S分子稳定是因为前者分子间存在氢键
C.干冰和氯化铵分别受热变为气体,克服的微粒间作用力相同
D.CH3CH2OH和CH3OCH3相对分子质量相同,因而沸点几乎相同
难度: 简单查看答案及解析
-
下列离子方程式正确的是( )
A.碳酸氢钠溶液中加入氢氧化钠溶液:HCO3-+OH-=CO2+H2O
B.向次氯酸钾溶液中滴入少量FeSO4溶液;2Fe2++ClO-+2H+=Cl-+2Fe3++H2O
C.Na2S2O3与稀H2SO4混合:S2O32-+2H+=S↓+SO2↑+H2O
D.用石墨电极电解MgCl2溶液:2Cl-+2H2O
2OH-+Cl2↑+H2↑
难度: 困难查看答案及解析
-
25℃,改变0.01mol/L CH3COONa溶液的pH,溶液中CH3COOH、CH3COO-、H+、OH-浓度的对数值1gc与溶液pH的变化关系如图所示。下列叙述不正确的是( )
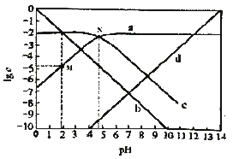
A.d线表示OH-
B.pH=6时,c(CH3COOH)>c(CH3COO-)>c(H+)
C.点M的纵坐标与点N的横坐标数值相等,符号相反
D.0.01mol·L-1 CH3COONa的pH约等于线c与线d交点处的横坐标值
难度: 困难查看答案及解析
-
钛是一种活泼金属。从高钛渣(主要为TiO2)提炼海绵钛流程如下:

氯化后的粗TiCl4中含有FeCl3、SiCl4、AlCl3等杂质,相关物质的沸点如下表:
化合物
TiCl4
FeCl3
SiCl4
AlCl3
沸点/℃
136
310
56.5
180
下列说法不正确的是( )
A.“氯化”反应的尾气中的HCl和Cl2经吸收可得粗盐酸、FeCl3溶液,则尾气的吸收液依次是H2O、FeCl2溶液、NaOH溶液
B.“分馏”得到的低沸点物为SiCl4,高沸点物为FeCl3
C.己知“除铝”的方法是用水湿润的活性炭加入到粗TiCl4,目的是将AlCl3转化为Al(OH)3而除去
D.“还原”过程中还原剂可以选择金属钠,气氛可以选择N2
难度: 困难查看答案及解析
-
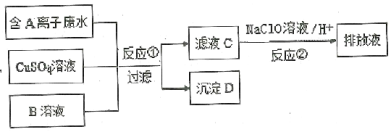
某固体粉末甲中可能含有K2CO3、KNO3、NaNO2、K2SO3、Na2SO4、Fe、FeO、Fe2O3中的若干种。某同学为确定该固体粉末的成分,取甲进行连续实验。实验过程及现象如下:

该同学得出的结论正确的是( )
A.固体粉末中含有钠元素,但不含钾元素
B.固体粉末中至少含有Na2SO4、K2SO3中的一种
C.固体粉末中至少含有KNO3、NaNO2中的一种
D.固体粉末中可能含有K2CO3、不含Fe2O3
难度: 困难查看答案及解析
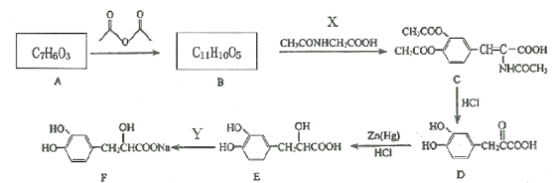
 ROOCCH3+CH3COOH
ROOCCH3+CH3COOH
 结构(R1、R2不为H、不含环、不含有“-C-N-”);
结构(R1、R2不为H、不含环、不含有“-C-N-”);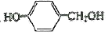 、CH3CHO为原料合成
、CH3CHO为原料合成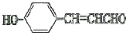 ___(用流程图表示,其它无机试剂任选)。
___(用流程图表示,其它无机试剂任选)。