-
下列叙述正确的是
A. 石英坩埚、水泥和陶瓷都是硅酸盐产品
B. “84”消毒液的有效成分是 NaClO,“洁厕灵”的有效成分为 HCl,若将两者混合使用,其杀菌效果和去除厕所污渍的效果都将加强
C. “玉兔号”月球车太阳能电池帆板的材料是二氧化硅
D. 高铁车厢大部分材料是铝合金,铝合金材料具有强度大、质量轻、抗腐蚀能力强等优点
难度: 简单查看答案及解析
-
下列各组物质之间的转化不是全部通过一步反应完成的是
A. Na→NaOH→Na2CO3→NaCl B. Al→Al2O3→Al(OH)3→AlCl3
C. Mg→MgCl2→Mg(OH)2→MgSO4 D. Fe→FeCl2→Fe(OH)2→Fe(OH)3
难度: 简单查看答案及解析
-
设 NA表示阿伏加徳罗常数的值。下列说法不正确的是
A. 常温下的新制氯水中,若含有的Cl-数为 NA,则其中含有的 ClO-数也为NA
B. 12.0 g熔融的NaHSO4中含有的阳离子数为0.1NA
C. 一定条件下,1.0 mol Cl2与足量铁完全反应转移的电子数为2 NA
D. 78 g Na2O2与足量CO2完全反应时转移的电子数为NA
难度: 中等查看答案及解析
-
下列叙述正确的是
A. 金属Na着火时立即用水灭火
B. 任何金属元素灼烧时都有焰色反应
C. 铝制餐具不宜用来蒸煮或长时间存放酸性、碱性或咸的食物
D. Na2CO3俗名纯碱、苏打,NaHCO3俗名为小苏打,两者的水溶液均呈碱性,故两者都属于碱类
难度: 简单查看答案及解析
-
下列叙述正确的是
A. SiO2 既能和NaOH 溶液反应,又能和氢氟酸反应,所以SiO2属于两性氧化物
B. 因为Na2CO3+SiO2
Na2SiO3+CO2↑,所以硅酸的酸性比碳酸强
C. CO2和SiO2都能与碳反应,且都作氧化剂
D. CO2和SiO2 都是酸性氧化物,所以两者物理性质相似
难度: 中等查看答案及解析
-
常温下,下列各组离子在指定溶液中一定能大量共存的是
A. 能溶解 Al(OH)3 的溶液: Na+、NH4+、NO3-、HCO3-
B. 能使紫色石蕊试液变蓝的溶液: Na+、K+、Cl-、CO32-
C. 含有0.1 mol/L SCN-的溶液: K+、Fe3+、NO3-、Cl-
D. c(Ba2+)=1.0 mol/L 的溶液: K+、NH4+、SO42-、 Cl-
难度: 中等查看答案及解析
-
将一定量的镁铝合金样品分成两等份,一份加入足量NaOH溶液中,充分反应后,收集到标准状况下气体 6.72 L;另一份加入到足量稀盐酸中,充分反应后,收集到标准状况下气体11.2 L。则原合金样品中镁的质量为
A. 4.8 g B. 8 g C. 9.6 g D. 12 g
难度: 中等查看答案及解析
-
下列叙述错误的是
A. 20 mL 溶质质量分数为98%的浓 H2SO4,用20 mL水稀释后, H2SO4的溶质质量分数大于49%
B. 配制0.1 mol/L的NaCl溶液240mL,需用250 mL容量瓶
C. 将不饱和的烧碱溶液分成两等份后分别加入一定量的Na2O2和Na2O,使溶液均恰好饱和,则加入的 Na2O2与Na2O的物质的量之比等于 1∶1(保持温度不变)
D. 在标准状况下,将 22.4 L HCl气体溶于1L水中,得到1 mol/L的盐酸
难度: 中等查看答案及解析
-
下列物质能用化合反应直接制得的是
①FeSO4 ②FeCl3 ③NaHCO3 ④Fe(OH)3 ⑤Fe(OH)2
A. ①②③④ B. ②③④ C. ②③④⑤ D. ①②③④⑤
难度: 简单查看答案及解析
-
在课堂上老师出示了失去标签的等物质的量浓度的Na2CO3和NaHCO3溶液,希望班里同学提出简便的鉴别方法,该班同学踊跃提出看法,其中不合理的是
①取等量的溶液于两支试管中,分别滴入几滴酚酞试液,红色较深的是Na2CO3溶液
②用干燥的 pH 试纸检验,pH小的是NaHCO3溶液
③取等量的溶液于两支试管中,分别滴加 Ba(OH)2 溶液,生成白色沉淀的是Na2CO3溶液
④取等量的溶液于两支试管中,分别逐滴加入稀盐酸,开始就有气体放出的是NaHCO3溶液
⑤取等量的溶液于两支试管中,分别滴加CaCl2溶液,生成白色沉淀的是Na2CO3溶液
A. ②③ B. ③ C. ③④ D. ①④⑤
难度: 中等查看答案及解析
-
下列关于工业生产的说法正确的是
A. 工业上以氯气和澄清石灰水为原料制造漂白粉
B. 工业上利用H2和Cl2的混合气体在光照下反应来制取盐酸
C. 工业上将氯气溶于NaOH溶液制备漂白粉
D. 漂白粉要干燥和密封保存
难度: 简单查看答案及解析
-
下列反应的离子方程式书写不正确的是
A. NaOH 溶液与 CO2反应,当 n(NaOH)∶n(CO2)=4∶3 时, 4OH-+3CO2=CO32-+2HCO3-+H2O
B. AlCl3溶液中加入过量氨水:Al3++ 4NH3·H2O= 4NH4++ AlO2-+2H2O
C. Cl2与FeBr2溶液反应,当n(Cl2)∶n(FeBr2) =1∶1 时,2Cl2+2Fe2++2Br-=4Cl-+2Fe3++Br2
D. 次氯酸钙溶液中通入过量 CO2:ClO-+CO2+H2O= HClO+HCO3-
难度: 中等查看答案及解析
-
除去下列括号内杂质的试剂或方法不正确的是
A. Fe2+(Fe3+):还原铁粉,过滤
B. Cl2(HCl):饱和食盐水,洗气
C. Na2O2粉末(Na2O):将混合物在氧气中充分加热
D. HNO3溶液(H2SO4):适量 BaCl2溶液,过滤
难度: 简单查看答案及解析
-
将a g含氧化铁、氧化铜和氧化亚铁的样品投入1L2 mol/L的盐酸中,恰好完全反应。若向等质量的该样品中通入足量的氢气并加热,则充分反应后所得金属的质量是
A. 16 g B. (a-16) g C. (a+16) g D. (a-32) g
难度: 中等查看答案及解析
-
从某含有 CuCl2、FeCl2、FeCl3的工业废液中回收铜并制备氯化铁晶体的流程如下:

则下列说法正确的是
A. 试剂a是铁、试剂b是稀硫酸
B. 操作Ⅰ、操作Ⅱ、操作Ⅲ所用的仪器完全相同
C. 试剂c是氯气,相应的离子反应为2Fe2++ Cl2=2Cl-+2Fe3+
D. 用KSCN溶液可检验溶液W中是否有Fe2+
难度: 中等查看答案及解析
-
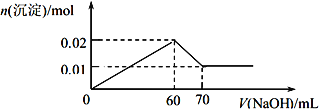
将一定质量由镁和铝组成的合金投入200 mL一定物质的量浓度的盐酸中,合金全部溶解,向所得溶液中滴加6 mol/L的NaOH溶液到过量,生成沉淀的质量与加入的NaOH溶液的体积关系如下图所示:
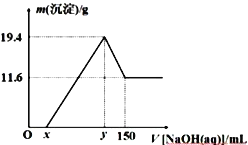
下列说法不正确的是
A. 镁铝合金中,Mg与Al的物质的量之比为 2∶1
B. 所用盐酸的物质的量浓度为4 mol/L
C. 图像中的x=20
D. 图像中,Ox 段的离子方程式为:H++OH-= H2O;y~150 段的离子方程式为:Al(OH)3+OH-=AlO2-+ 2H2O
难度: 中等查看答案及解析
-
将一定量的氯气通入60mL10mol/L.热的NaOH浓溶液中,恰好完全反应,溶液中形成NaCl、NaClO 和NaClO3的共存体系。下列判断正确的是
A. 与NaOH反应的氯气一定为0.3mol
B. 反应后的溶液中,n(Na+): n(Cl-)可能为7 :3
C. 该反应的氧化产物为NaClO3
D. n(NaCl):n(NaClO) :n(NaClO3)可能为11: 2: 1
难度: 困难查看答案及解析
-
某溶液仅含 Fe2+、Na+、Al3+、Ba2+、SO42-、NO3-、Cl-中的 4 种离子, 所含离子的物质的量均为 1 mol。若向该溶液中加入过量的稀硫酸,有气体产生,且溶液中阴离子种类不变(不考虑水的电离和盐类水解)。下列说法不正确的是
A. 该溶液所含的离子: Fe2+、Na+、SO42-、NO3-
B. 加入过量的稀硫酸时,产生的气体在空气中能变红棕色
C. 若向该溶液中加入过量的稀硫酸和KSCN溶液,溶液显血红色
D. 若向该溶液中加足量的NaOH溶液,充分反应后,过滤、洗涤、灼烧,最后所得固体的质量为 72 g
难度: 中等查看答案及解析
-
某混合物X由 Al2O3、Fe2O3、Cu、SiO2中的一种或几种物质组成。进行如下实验:

下列有关说法正确的是
A. 步骤Ⅰ中减少的3g固体一定是混合物
B. 步骤Ⅱ中质量减少的物质一定是Cu
C. 根据步骤Ⅰ、Ⅱ可以判断混合物X的成分为 Al2O3、Fe2O3、Cu、SiO2
D. 根据上述步骤Ⅱ可以得出 m(Fe2O3)∶m(Cu)=1∶1
难度: 困难查看答案及解析
-
将总的物质的量为 n mol 的钠和铝的混合物(其中钠的物质的量分数为 x),投入一定量的水中充分反应,金属没有剩余,共收集到标准状况下的气体V L。下列关系式中正确的是
A. x=V/11.2n B. 0 <x≤0.5
C. V=33.6n(1-x) D. 11.2n<V≤22.4n
难度: 困难查看答案及解析