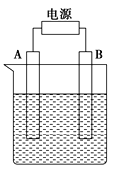
-
250℃和1.01×105 Pa时,该反应能自发进行:2N2O5(g) = 4NO2(g) + O2(g) △H= +56.76 kJ/mol,其自发进行的原因是
A. 是吸热反应 B. 是放热反应
C. 是熵减少的反应 D. 熵增大效应大于能量效应
难度: 中等查看答案及解析
-
在一密闭容器中进行反应2SO2+O2⇌2SO3,已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.2mol/L、0.1mol/L、0.2mol/L,当反应达平衡时,可能存在的数据是( )
A.SO2为0.4mol/L,O2为0.2mol/L
B.SO2为0.25mol/L
C.SO2、SO3均为0.15mol/L
D.SO3为0.4mol/L
难度: 中等查看答案及解析
-
将氨水缓缓地滴入盐酸中至中性,下列有关的说法:①盐酸过量 ②氨水过量 ③恰好完全反应 ④c (NH4+) = c(Cl-) ⑤c (NH4+) < c(Cl-) 正确的是
A.②④ B.③④ C.②⑤ D.①⑤
难度: 中等查看答案及解析
-
把a、b、c、d四块金属片浸入稀硫酸中,用导线两两相连可以组成几个原电池。若a、b 相连时a为负极;c、d相连时电流由d到c;a、c相连时c上产生大量气泡;b、d相连时b上有大量气泡产生,则四种金属的活动性顺序由强到弱为( )
A.a>c>d>b B.a>b>c>d C.c>a>b>d D.b>d>c>a
难度: 简单查看答案及解析
-
下列实验操作和数据记录都正确的是
A.用25 mL碱式滴定管量取高锰酸钾溶液,体积为16.60 mL
B.用标准NaOH溶液滴定未知浓度盐酸,用去NaOH溶液20.50 mL
C.用10 mL量筒量取8.25 mL盐酸
D.用pH试纸测得某溶液pH为3.2
难度: 简单查看答案及解析
-
能在溶液中大量共存的一组离子是
A. NH4+、Ag+、PO43-、Cl- B. Fe3+、H+、I-、HCO3-
C. K+、Na+、NO3-、MnO4- D. Al3+、Mg2+、SO42-、CO32-
难度: 中等查看答案及解析
-
在密闭容器里,A与B反应生成C,其反应速率分别用vA、vB、vC表示,已知2vB=3vA、3vc=2vB,则此反应可表示为( )
A.2A+3B=2C B.A+3B=2C C.3A+B=2C D.A+B=C
难度: 简单查看答案及解析
-
下列化学用语书写正确的是( )
A. 次氯酸的电离方程式:HClO===H++ClO-
B. 铝溶于烧碱溶液的离子方程式:Al+2OH-==AlO2-+H2↑
C. 电解精炼铜的阴极反应式:Cu-2e-==Cu2+
D. 已知中和热为57.3 kJ·mol-1,稀硫酸与氢氧化钠稀溶液反应的热化学方程式:H2SO4 (aq)+2NaOH(aq)==Na2SO4(aq)+2H2O(l) ΔH=-114.6 kJ·mol-1
难度: 中等查看答案及解析
-
可逆反应2SO2(g)+O2(g)
2SO3(g),如果SO2的起始浓度为2mol·L-1,2min后SO2的浓度为1.8 mol·L-1,则用O2的浓度变化表示的反应速率为( )
A.0.1mol·L-1·min-1 B.0.05mol·L-1·min-1
C.0.2 mol·L-1·min-1 D.0.9mol·L-1·min-1
难度: 简单查看答案及解析
-
已知25 ℃ 时,AgCl 的溶度积Ksp=1.8×10-10,则下列说法正确的是( )
A.向饱和AgCl水溶液中加入盐酸,Ksp值变大
B.AgNO3溶液与NaCl溶液混合后的溶液中,一定有c(Ag+)=c(Cl-)
C.温度一定时,当溶液中c(Ag+)×c(Cl-)=Ksp时,此溶液中必有AgCl的沉淀析出.
D.将AgCl加入到较浓的KI溶液中,部分AgCl转化为AgI,因为AgCl溶解度大于AgI
难度: 中等查看答案及解析
-
通常人们把拆开1 mol某化学键所消耗的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,也可用于估算化学反应的反应热。
化学键
Si—O
Si—Cl
H—H
H—Cl
Si—Si
Si—C
键能/kJ·mol-1
460
360
436
431
176
347
工业上高纯硅可通过下列反应制取:SiCl4(g)+2H2(g)
Si(s)+4HCl(g),该反应的反应热△H为
A. +236 kJ·mol-1 B. -236 kJ·mol-1
C. +412 kJ·mol-1 D. -412 kJ·mol-1
难度: 简单查看答案及解析
-
下列说法,你认为不正确的是( )
A.平衡常数随温度的改变而改变
B.对于密闭容器中反应2SO2+O2
2SO3,2体积SO2与足量O2反应,能生成2体积SO3
C.合成氨反应中使用催化剂,降低了反应所需要的活化能
D.反应H2(g)+I2 (g)
2HI(g) 在450℃时,其平衡常数为49;则反应HI(g)
1∕2 H2(g) +1∕2 I2(g) 在450℃时的平衡常数为1/7
难度: 中等查看答案及解析
-
下列对化学平衡移动的分析中,不正确的是
①已达平衡的反应C(s)+H2O(g)
CO(g)+H2(g),当增加反应物物质的量时,平衡一定向正反应方向移动 ②已达平衡的反应N2(g)+3H2(g)
2NH3(g),当增大N2的浓度时,平衡向正反应方向移动,N2的转化率一定升高 ③有气体参加的反应达到平衡时,若减小反应器容积时,平衡一定向气体体积增大的方向移动 ④有气体参加的反应达平衡时,在恒压反应器中充入稀有气体,平衡一定不移动
A.①④ B.①②③ C.②③④ D.①②③④
难度: 中等查看答案及解析
-
某种氢氧燃料电池的电解液为KOH溶液,下列有关该电池的叙述不正确的是( )
A. 正极反应式为:O2+2H2O+4e-=4OH-
B. 工作一段时间后,电解液中KOH的物质的量不变
C. 该燃料电池的总反应方程式为:2H2+O2=2H2O
D. 用该电池电解CuCl2溶液,产生2.24 L Cl2(标准状况)时,有0.1 mol电子转移
难度: 中等查看答案及解析
-
下列热化学方程式中.△H能正确表示物质的燃烧热的是( )
A.CO(g) +
O2(g) ==CO2(g); △H=-283.0 kJ/mol
B.C(s) +
O2 ==CO(g); △H=-110.5 kJ/mol
C.H2(g) +
O2(g)==H2O(g); △H=-241.8 kJ/mol
D.2C8H18(l) +25O2(g)==16 CO2(g)+18 H2O(l); △H=-1136 kJ/mol
难度: 简单查看答案及解析
-
常温下,某溶液中由水电离出来的c(H+)=1.0×10-13mol·L-1,该溶液可能是( )
①二氧化硫 ②氯化铵水溶液 ③硝酸钠水溶液 ④氢氧化钠水溶液
A.①④ B.①② C.②③ D.③④
难度: 中等查看答案及解析
-
如图所示各容器中盛有海水,铁在其中被腐蚀由快到慢的顺序是
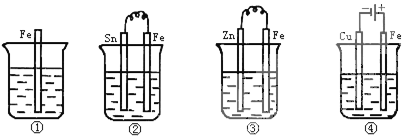
A. ④>②>①>③ B. ②>①>③>④ C. ③>②>④>① D. ④>②>③>①
难度: 中等查看答案及解析
-
下列实验操作能达到目的的是
①用Na2S溶液和Al2(SO4)3溶液反应制取Al2S3固体 ②用加热蒸发K2CO3溶液的方法获得K2CO3晶体③用Na2S溶液和CuSO4溶液反应制取CuS固体 ④加热MgCl2溶液制取MgCl2固体
A.①② B.②③ C.③④ D.①③
难度: 中等查看答案及解析
-
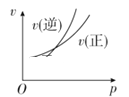
对于可逆反应A(g)+2B(g)
2C(g)(正反应吸热),下列图象正确的是
A.
 B.
B. 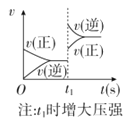 C.
C. 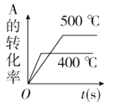 D.
D. 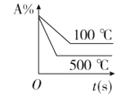
难度: 困难查看答案及解析
-
高铁电池是一种新型可充电电池,该电池的总反应为:3Zn+2K2FeO4+8H2O
3Zn(OH)2+2Fe(OH)3+4KOH下列叙述不正确的是( )
A.放电时正极附近溶液的碱性减弱
B.充电时阳极反应为:Fe(OH)3-3eˉ+5OHˉ=FeO42ˉ+4H2O
C.放电时每转移 3 mol 电子,正极有 1 mol K2FeO4 被还原
D.放电时负极反应为:Zn-2eˉ+2OHˉ=Zn(OH)2
难度: 中等查看答案及解析
-
pH=13的 强碱与pH=2的强酸溶液混合,所得混合液的pH=11,则强碱与强酸的体积比为
A.9:1 B.1:11 C.1:9 D.11:1
难度: 简单查看答案及解析
-
用惰性电极电解CuSO4 和KNO3的混合溶液500mL,经过一段时间后,两极均得到标准状况下11.2L的气体,则原混合液中CuSO4的物质的量浓度为( )
A.0.5 mol•L﹣1 B.0.8 mol•L﹣1 C.1.0 mol•L﹣1 D.1.5 mol•L﹣1
难度: 中等查看答案及解析
-
恒温、恒压下,反应N2(g)+3H2(g)
2NH3(g)从两条途径分别建立平衡:
Ⅰ.N2、H2的起始浓度分别为1 mol / L和3 mol / L;
Ⅱ.NH3的起始浓度为4 mol / L。下列有关叙述不正确的是:
A.途径Ⅰ与途径Ⅱ所得混合气体的百分组成相同
B.途径Ⅰ的平衡速率v (N2)与途径Ⅱ的平衡速率v (NH3)的比值为1∶2
C.途径Ⅰ所得NH3的浓度与途径Ⅱ所得NH3的浓度之比为1∶2
D.途径Ⅰ与途径Ⅱ所得平衡混合气体的物质的量之比为1∶2
难度: 中等查看答案及解析
-
某次酸雨的分析数据如下:c(NH4+)=2.0×10-5 mol/L,c(Na+)=1.9×10-5 mol/L,c(Cl-)=6.0×10-5 mol/L,c(NO3-)=2.3×10-5 mol/L,c(SO42-)=2.8×10-5 mol/L,则此次酸雨的pH大约为
A. 3 B. 4 C. 5 D. 6
难度: 简单查看答案及解析
-
下列关于溶液中离子的说法正确的是( )
A.0.1 mol·L-1的Na2CO3溶液中离子浓度关系:c (Na+)=2c (CO32-)+c (HCO3-)+c (H2CO3)
B.0.1 mol·L-1的NH4Cl和0.1 mol·L-1的NH3·H2O等体积混合后溶液中的离子浓度关系:c(Cl-)>c(NH4+)>c(H+)>c(OH-)
C.常温下,醋酸钠溶液中滴加少量醋酸使溶液的pH<7,则混合溶液中,离子浓度关系:c (Na+)=c (CH3COO-)
D.0.1 mol·L-1的NaHS溶液中离子浓度关系:c (OH-)=c (H+)-c (S2-)+c (H2S)
难度: 中等查看答案及解析