-
在密闭容器中进行反应①Fe(s)+CO2(g)  FeO(s)+CO(g) ΔH1=akJ·mol-1
FeO(s)+CO(g) ΔH1=akJ·mol-1
反应②2CO(g)+O2(g)  2CO2(g) △H2=b kJ·mol-1
2CO2(g) △H2=b kJ·mol-1
反应③2Fe(s)+O2(g)  2FeO(s) △H3
2FeO(s) △H3
(1)△H3=_____________________________(用含a、b的代数式表示)。
(2)反应①的化学平衡常数表达式K=_________________________,已知500℃时反应①的平衡常数K=1.0,在此温度下2 L密闭容器中进行反应①,Fe和CO2的起始量均为2.0mol,达到平衡时CO2的转化率为_____________________________,CO的平衡浓度为_____________________________。
(3)将上述平衡体系升温至700℃,再次达到平衡时体系中CO的浓度是CO2浓度的两倍,则a_____0(填“>”、“<”或“=”)。为了加快化学反应速率且使体系中CO的物质的量增加,其他条件不变时,可以采取的措施有_____________________________(填序号)。
A.缩小反应器体积 B.再通入CO2 C.升高温度 D.使用合适的催化剂
(4)在密闭容器中,对于反应:2SO2(g)+O2(g)  2SO3(g),SO2和O2起始时分别为20 mol和10 mol;达平衡时,SO2的转化率为80%。若从SO3开始进行反应,在相同的温度下,欲使平衡时各成分的百分含量与前者相同,则起始时SO3的物质的量为_____________,其转化率为____________。
2SO3(g),SO2和O2起始时分别为20 mol和10 mol;达平衡时,SO2的转化率为80%。若从SO3开始进行反应,在相同的温度下,欲使平衡时各成分的百分含量与前者相同,则起始时SO3的物质的量为_____________,其转化率为____________。
-
在密闭容器中进行反应①Fe(s)+CO2(g) FeO(s)+CO(g) ΔH1=akJ·mol一1
FeO(s)+CO(g) ΔH1=akJ·mol一1
反应②2CO(g)+O2(g) 2CO2(g) △H2=b kJ·mol-1
2CO2(g) △H2=b kJ·mol-1
反应③2Fe(s)+O2(g) 2FeO(s) △H3
2FeO(s) △H3
(1) △H3= (用含a、b的代数式表示)。
(2)反应①的化学平衡常数表达式K= ,已知500℃时反应①的平衡常数K=1.0,在此温度下2 L密闭容器中进行反应①,Fe和CO2的起始量均为2.0 mol,达到平衡时CO2的转化率为 ,CO的平衡浓度为 。
(3)将上述平衡体系升温至700℃,再次达到平衡时体系中CO的浓度是CO2浓度的两倍,则a 0(填“>”、“<”或“=”)。为了加快化学反应速率且使体系中CO的物质的量增加,其他条件不变时,可以采取的措施有 (填序号)。
A.缩小容器的体积 B.再通入CO2
C.升高温度 D.使用合适的催化剂
(4)下列图像符合反应①的是 (填序号)(图中V是速率、φ为混合物中CO含量,T为温度)。
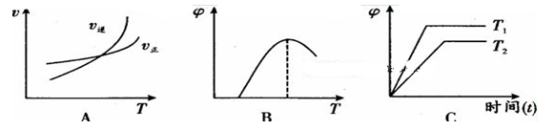
-
在密闭容器中进行反应:①Fe(s)+CO2(g) FeO(s)+CO(g) ΔH1=a kJ·mol-1 反应②2CO(g)+O2(g)
FeO(s)+CO(g) ΔH1=a kJ·mol-1 反应②2CO(g)+O2(g) 2CO2(g) △H2=bkJ·mol-1
2CO2(g) △H2=bkJ·mol-1
(1)写出铁块与氧气生成1mol氧化亚铁固体的热化学方程式____。
(2)反应①的化学平衡常数表达式K=___,已知500℃时反应①的平衡常数K=1.0,在此温度下2L密闭容器中进行反应①,Fe和CO2的起始量均为2.0mol,达到平衡时CO2的转化率为___,CO的平衡浓度为____。
(3)反应②的逆反应速率与时间的关系如图所示。由图可知,反应在t1、t3时都达到了平衡,而t2、t4时都只改变了一种条件,试判断改变的条件:t2时___;t4时____。
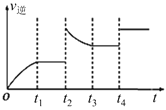
-
反应①Fe(s)+CO2(g)=FeO(s)+CO(g);△H1=akJmol-1
反应②CO(g)+ O2(g)=CO2(g);△H2=bkJmol-1
O2(g)=CO2(g);△H2=bkJmol-1
测得在不同温度下,在密闭容器中进行的反应①的平衡常数K值随温度的变化如下:
| 温度/℃ | 500 | 700 | 900 |
| K | 1.00 | 1.46 | 2.51 |
(1)反应①的化学平衡常数表达式为___,a___0(填“>”、“<”或“=”)。在500℃2L密闭容器中进行反应①,Fe和CO2的起始物质的量均为4mol,10min后达到平衡状态,平衡时CO2的转化率为___,用CO表示的化学反应速率为___。
(2)700℃反应①到平衡,要使该平衡向右移动,其它条件不变时,可以采取的措施有___(填序号)。
A.缩小反应容器体积
B.通入CO2
C.升高温度到900℃
D.使用合适的催化剂
(3)由反应①和②可求得反应2Fe(s)+O2(g)=2FeO(s)△H3中的△H3=___(用含a、b的代数式表示)。
-
在1100℃,一定容积的密闭容器中发生反应:FeO(s)+CO(g) Fe(s)+CO2(g) △H=a kJ/mol(a >0),下列有关该反应的说法正确的是( )
Fe(s)+CO2(g) △H=a kJ/mol(a >0),下列有关该反应的说法正确的是( )
A. 若生成1 mol Fe,则吸收的热量小于a kJ
B. 若升高温度,正反应速率加快,逆反应速率加快,则化学平衡正向移动
C. 若增大压强反应向正反应方向进行
D. 若容器内压强不随时间变化,则可以判断该反应已达到化学平衡状态
-
在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g) CO(g)+H2O(g)
CO(g)+H2O(g)
△H=aKJ·mol-1,其化学平衡常数K和温度t的关系如下表:
| t/℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
下列说法中正确的是
A.该反应的正反应为吸热反应,即a>0
B.当υ正(H2)=υ正(H2O )时,该反应达到化学平衡状态
C.当其他条件不变时,若缩小容器的体积,则有利于该反应平衡正向移动
D.当平衡浓度符合c(CO2)·c(H2)=c(CO)·c(H2O)时的温度为830℃、、
-
铁及其化合物与生产、生活关系密切。已知t℃时,反应FeO(s)+CO(g) Fe(s)+CO2(g)的平衡常数K=0.25。若在2 L密闭容器中加入0.02mol FeO(s),并通入xmolCO,t℃时反应达到平衡。此时FeO(s)转化率为50%,则x的值为( )
Fe(s)+CO2(g)的平衡常数K=0.25。若在2 L密闭容器中加入0.02mol FeO(s),并通入xmolCO,t℃时反应达到平衡。此时FeO(s)转化率为50%,则x的值为( )
A.0.1 B.0.05 C.0.04 D.0.02
-
在1100℃,一定容积的密闭容器中发生反应:FeO(s)+CO(g) Fe(s)+CO2(g)
Fe(s)+CO2(g)
△H="a" kJ/mol(a >0),该温度下K = 0.263,下列有关该反应的说法正确的是( )
A.若生成1 mol Fe,则吸收的热量小于a kJ
B.若升高温度,正反应速率加快,逆反应速率减慢,则化学平衡正向移动
C.若容器内压强不随时间变化,则可以判断该反应已达到化学平衡状态
D.达到化学平衡状态时,若c(CO)="0.100" mol/L,则c(CO2)="0.0263" mol/L
-
在1100℃,一定容积的密闭容器中发生反应:FeO(s)+CO(g)  Fe(s)+CO2(g) △H=a kJ/mol(a >0),该温度下K=0.263,下列有关该反应的说法正确的是( )
Fe(s)+CO2(g) △H=a kJ/mol(a >0),该温度下K=0.263,下列有关该反应的说法正确的是( )
A. 若生成1 mol Fe,则吸收的热量小于a kJ
B. 若升高温度,正反应速率加快,逆反应速率减慢,则化学平衡正向移动
C. 若容器内压强不随时间变化,则可以判断该反应已达到化学平衡状态
D. 达到化学平衡状态时,若c(CO)=0.100 mol/L,则c(CO2)=0.0263 mol/L
-
在1100℃,一定容积的密闭容器中发生反应:FeO(s)+CO(g)  Fe(s)+CO2(g) △H=a kJ/mol(a >0),该温度下K=0.263,下列有关该反应的说法正确的是( )
Fe(s)+CO2(g) △H=a kJ/mol(a >0),该温度下K=0.263,下列有关该反应的说法正确的是( )
A. 若生成1 mol Fe,则吸收的热量小于a kJ
B. 若升高温度,正反应速率加快,逆反应速率减慢,则化学平衡正向移动
C. 若容器内压强不随时间变化,则可以判断该反应已达到化学平衡状态
D. 达到化学平衡状态时,若c(CO)=0.100 mol/L,则c(CO2)=0.0263 mol/L
FeO(s)+CO(g) ΔH1=akJ·mol-1
2CO2(g) △H2=b kJ·mol-1
2FeO(s) △H3
2SO3(g),SO2和O2起始时分别为20 mol和10 mol;达平衡时,SO2的转化率为80%。若从SO3开始进行反应,在相同的温度下,欲使平衡时各成分的百分含量与前者相同,则起始时SO3的物质的量为_____________,其转化率为____________。

