-
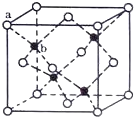
我国科学家通过测量SiO2中26Al和10Be两种元素的比例来确定“北京人”年龄,这种测量方法叫铝铍测年法。关于26Al和10Be的说法不正确的是
A.10Be和9Be是中子数不同质子数相同的不同原子
B.10Be的原子核内中子数比质子数多
C.5.2 g26Al3+中所含的电子数约为1.2×1024
D.26Al和26Mg的质子数、中子数和核外电子数都不相同
难度: 中等查看答案及解析
-
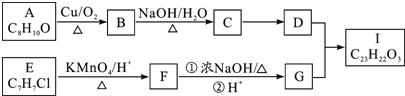
下列有关化学用语表示正确的是( )
A.NH4I的电子式:
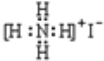
B.Fe2+原子结构示意图:
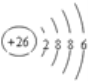
C.含10个中子的氧原子的核素符号:
O
D.HClO的结构式:H−Cl−O
难度: 简单查看答案及解析
-
下列反应中热量变化与图一致的是
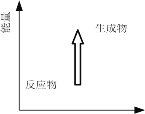
A.天然气的燃烧 B.油脂在人体内氧化
C.NaOH溶液和 HNO3溶液反应 D.氢氧化钡晶体和氯化铵晶体反应
难度: 简单查看答案及解析
-
氧化亚铜常用于制船底防污漆。用CuO与Cu高温烧结可制取
,已知反应:
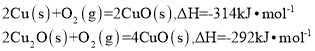
则
的
等于
A.
B.
C.
D.
难度: 简单查看答案及解析
-
如图表示可逆反应A(g)+3B(g)⇌2C(g) △H<0达平衡后,t1时改变某一反应条件,反应速率随时间变化的情况,根据曲线判断下列说法中正确的是( )
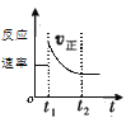
A.t1时降低了温度,平衡向正反应方向移动
B.t1时增大了压强,平衡向正反应方向移动
C.t1时可能使用了催化剂
D.t1时增大了A的浓度,同时减小了C的浓度,平衡向正反应方向移动
难度: 简单查看答案及解析
-
如图所示是一种以液态肼(N2H4)为燃料,氧气为氧化剂,某固体氧化物为电解质的新型燃料电池。该固体氧化物电解质的工作温度高达700−900℃时,O2−可在该固体氧化物电解质中自由移动,反应生成物均为无毒无害的物质。下列说法正确的是( )
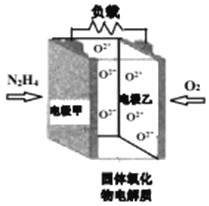
A.电池内的O2−由电极乙移向电极甲
B.电池总反应为N2H4+2O2=2NO+2H2O
C.当甲电极上有lmolN2H4消耗时,乙电极上有22.4LO2参与反应
D.电池外电路的电子由电极乙移向电极甲
难度: 简单查看答案及解析
-
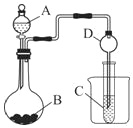
烧杯A中盛放0.1mol/L的H2SO4溶液,烧杯B中盛放0.1mol/L的的CuCl2溶液(两种溶液均足量),组成的装置如图所示。下列说法不正确的是( )
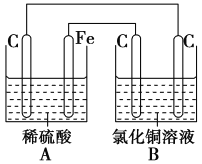
A.A为原电池,B为电解池
B.A为电解池,B为原电池
C.当A烧杯中产生0.1mol气体时,B烧杯中产生气体的物质的量也为0.1mol
D.经过一段时间,B烧杯中溶液的浓度减小
难度: 简单查看答案及解析