-
港珠澳大桥使用了大量的含钒高强抗震钢材。该钢材与生铁比较错误的是
A.抗震性好 B.耐腐蚀强 C.含碳量高 D.都导电导热
难度: 简单查看答案及解析
-
对石油和煤的分析错误的是
A.都是混合物 B.都含有机物
C.石油裂化和煤干馏得到不同的产品 D.石油分馏和煤干馏原理相同
难度: 简单查看答案及解析
-
元素周期表中,铟(In)与铝同主族,与碘同周期。由此推断
A.In最外层有5个电子 B.In的原子半径小于I
C.In(OH)3的碱性强于Al(OH)3 D.In属于过渡元素
难度: 简单查看答案及解析
-
氮化碳(C3N4)的硬度大于金刚石,则氮化碳中
A.只有共价键 B.可能存在离子
C.可能存在N≡N D.存在极性分子
难度: 简单查看答案及解析
-
工业上可用铝热反应冶炼锰、钒等难熔金属,其原因与下列无关的是
A.铝还原性较强 B.铝能形成多种合金
C.铝相对锰、钒较廉价 D.反应放出大量的热
难度: 简单查看答案及解析
-
与氢硫酸混合后无明显现象的是
A.NaOH溶液 B.亚硫酸 C.FeCl3溶液 D.氯水
难度: 简单查看答案及解析
-
同温同压下,热化学方程式中反应热数值最大的是
A.2W(l)+Y(l)→2Z(g) +Q1 B.2W(g)+Y(g)→2Z(l) +Q2
C.2W(g)+Y(g)→2Z(g) +Q3 D.2W(l)+Y(l)→2Z(l) +Q4
难度: 简单查看答案及解析
-
同温同压同体积的H2和CO
A.密度不同 B.质量相同 C.分子大小相同 D.分子间距不同
难度: 简单查看答案及解析
-
没有涉及到氧化还原反应的是
A.Fe3+和淀粉检验I- B.氯水和CCl4检验Br-
C.新制Cu(OH)2、加热检验醛基 D.硝酸和AgNO3溶液检验Cl-
难度: 简单查看答案及解析
-
向FeCl3、CuCl2、盐酸的混合溶液中加入铁粉充分反应后,用KSCN溶液检验无明显现象,则反应后的溶液一定
A.含Cu2+ B.含Fe2+ C.呈中性 D.含Fe2+和Cu2+
难度: 简单查看答案及解析
-
异戊烷的
A.沸点比正己烷高 B.密度比水大
C.同分异构体比C5H10多 D.碳碳键键长比苯的碳碳键长
难度: 简单查看答案及解析
-
杜瓦苯(
)与苯互为同分异构体,则杜瓦苯
A.最简式是CH2 B.分子中所有原子共平面
C.能使酸性高锰酸钾溶液褪色 D.是CH2=CH-CH=CH2的同系物
难度: 简单查看答案及解析
-
NA代表阿伏加德罗常数的值。4g α粒子(4He2+)含
A.2NA个α粒子 B.2NA个质子 C.NA个中子 D.NA个电子
难度: 简单查看答案及解析
-
对下列事实的原因分析错误的是
选项
事实
原因
A
用铝制容器盛装浓硫酸
常温下,铝与浓硫酸很难反应
B
氧化铝作耐火材料
氧化铝熔点高
C
铝制品不宜长期盛放酸性和碱性食物
氧化铝是两性氧化物
D
用可溶性铝盐和氨水制备氢氧化铝
氢氧化铝碱性比氨水弱且很难与氨水反应
A.A B.B C.C D.D
难度: 简单查看答案及解析
-
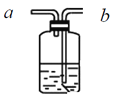
用如图装置进行实验,1小时后观察到生铁明显锈蚀,由此得出的结论是

A.属于化学腐蚀
B.O2未参与反应
C.负极反应2Fe-6e+3H2O→Fe2O3+6H+
D.正极反应O2+4e- +2H2O→4OH-
难度: 简单查看答案及解析
-
向Ca(HCO3)2饱和溶液中加入一定量的Na2O2(设溶液体积不变),推断正确的是
A.产生CO2气体 B.产生白色沉淀
C.所得溶液的碱性一定减弱 D.所得溶液中一定不含HCO3-
难度: 简单查看答案及解析
-
用石墨电极电解饱和食盐水,下列分析错误的是
A.得电子能力H+>Na+,故阴极得到H2
B.水电离平衡右移,故阴极区得到OH-
C.失电子能力Cl->OH-,故阳极得到Cl2
D.OH-向阴极移动,故阳极区滴酚酞不变红
难度: 简单查看答案及解析
-
在2L的密闭容器中,发生反应:C(s)+H2O(g)
CO(g)+H2(g)+131.5kJ,5min后达到平衡,固体减少了24g,则
A.ρ气体不变时反应达到平衡状态 B.v正(CO)为2.4mol/(L∙min)
C.若容器体积缩小,平衡常数减小 D.增大C的量,平衡右移
难度: 简单查看答案及解析
-
向新制氯水中逐滴滴加NaOH溶液,溶液pH随时间的变化如图所示。呈碱性时停止滴加,一段时间后溶液黄绿色逐渐褪去。由此得不到的结论是
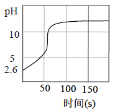
A.该新制氯水c(H+)=10-2.6mol/L
B.开始阶段,pH迅速上升说明H+被中和
C.OH-和Cl2能直接快速反应
D.NaOH和氯水反应的本质是OH-使Cl2+H2O
H++Cl-+HClO平衡右移
难度: 简单查看答案及解析
-
25℃,将浓度均为0.1mol/L的HA溶液Va mL和BOH溶液Vb mL混合,保持Va+Vb=100mL,生成物BA易溶于水。Va、Vb与混合液pH的关系如下图。下列叙述错误的是

A.HA一定是弱酸
B.BOH可能是强碱
C.z点时,水的电离被促进
D.x、y、z点时,溶液中都存在c(A-)+c(OH-)=c(B+)+c(H+)
难度: 简单查看答案及解析
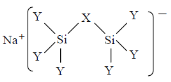




 为原料制备
为原料制备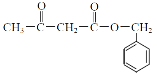 的合成路线。(无机试剂任用)_____________________。
的合成路线。(无机试剂任用)_____________________。