-
下列说法正确的是( )
A. 向Na2CO3溶液中通入CO2,可使水解平衡向正反应方向移动,溶液的pH增大
B. 在0.1 mol·L-1盐酸中加入适量的蒸馏水,溶液中各种离子的物质的量浓度均减小
C. NH3·H2O溶液加水稀释后,溶液中c(NH3·H2O)和c(NH4+)的比值减小
D. 常温下,pH均为5的盐酸与氯化铵溶液中,水的电离程度相同
难度: 困难查看答案及解析
-
下列对生产、生活中的有关问题认识正确的是( )
A. 用新能源代替化石燃料,可以减少雾霾天气的发生
B. 采用催化转换技术提高汽车尾气中有害气体的转化率
C. 明矾、活性炭、氯化铁等净水剂,使用时均利用了水解的原理
D. 氢氧燃料电池、铅蓄电池、硅太阳能电池中都利用了原电池原理
难度: 中等查看答案及解析
-
下列说法正确的是( )
A. 碳燃烧的热化学方程式为C(s)+1/2O2(g)=CO(g) ΔH=+110.5kJ·mol-1
B. 镀锌铁皮发生电化学腐蚀时,负极反应式为:Zn-2e–= Zn2+
C. NaHS水解的离子方程式是:HS﹣+H2O
S2﹣+H3O+
D. 溶液中碳酸的电离方程式为:H2CO3
2H++ CO32–
难度: 中等查看答案及解析
-
在CH3COOH
H++CH3COO﹣的电离平衡中,要使电离平衡向左移动,应采取的措施是( )
A. 加冰醋酸 B. 加CH3COONa C. 加水 D. 加NaOH
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值,下列说法正确的是( )
A. 常温下,pH=1的盐酸中,含H+ 的数目为0.1NA
B. 含有1mol NH4Cl和少量NH3·H2O的中性溶液中,NH4+数目为NA
C. 密闭容器中,2molSO2与1molO2充分反应后生成SO3的分子数为2NA
D. 电解饱和食盐水,当阴极产生2.24L H2时,转移的电子数一定为0.2NA
难度: 中等查看答案及解析
-
下列说法中正确的是( )
A. 盐酸的导电能力一定比醋酸的导电能力强
B. 一定量的锌粒与足量稀硫酸反应,向反应混合液中加入醋酸钠固体,产生H2速率减小,H2体积减小
C. 同温度下,0.1mol·L-1氨水中NH4+的浓度比0.1mol·L-1NH4Cl溶液中NH4+的浓度小
D. 将CuCl2溶液在蒸发皿中加热蒸干并灼烧可得到CuCl2固体
难度: 中等查看答案及解析
-
下列事实能说明亚硝酸是弱电解质的是( )
①25℃时亚硝酸钠溶液的pH大于7 ②用HNO2溶液做导电试验,灯泡很暗
③HNO2溶液不与Na2SO4溶液反应 ④0.1mol·L-1 HNO2溶液的pH=2.1
A. ①②③ B. ②③④ C. ①④ D. ①②④
难度: 中等查看答案及解析
-
常温下某溶液中水电离出的c(H+)=1×10-10 mol•L-1,下列离子在该溶液中一定能大量共存的是( )
A. NH4+、Fe2+、NO3-、SO42- B. Na+、K+、Cl-、SO42-
C. Mg2+、H+、Cl-、NO3- D. K+、Ca2+、HCO3-、Cl-
难度: 中等查看答案及解析
-
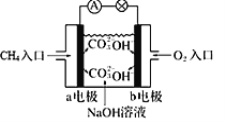
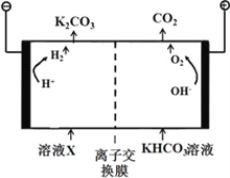
一种可充电锂-空气电池如图所示。当电池放电时,O2与Li+在多孔碳材料电极处生成Li2O2-x(x=0或1)。下列说法正确的是( )

A. 放电时,多孔碳材料电极为负极
B. 放电时,外电路电子由多孔碳材料电极流向锂电极
C. 充电时,电解质溶液中Li+向多孔碳材料区迁移
D. 充电时,电池总反应为Li2O2-x=2Li+(1—
)O2
难度: 中等查看答案及解析
-
支撑海港码头基础的钢管桩,常用下图的方法进行防腐,工作原理如图所示,其中高硅铸铁为惰性辅助阳极。下列有关表述不正确的是( )

A. 该保护方法称为外加电流的阴极保护法
B. 通电后外电路电子被强制从高硅铸铁流向钢管柱
C. 高硅铸铁的作用是作为损耗阳极材料和传递电流
D. 通入的保护电流应该根据环境条件变化进行调整
难度: 中等查看答案及解析
-
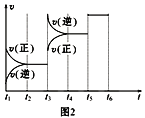
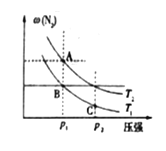
下列图示与对应的叙述相符的是( )
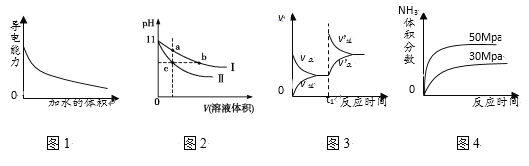
A. 图1表示一定量冰醋酸晶体加水过程中溶液导电性的变化
B. 图2表示某温度下,相同pH的氨水和氢氧化钠溶液分别加水稀释,a、b、c三点溶液的KW:c=b<a
C. 图3表示t1时刻改变的条件为升高温度,平衡向逆反应方向移动
D. 图4表示一定条件下,合成氨反应中压强对氨气体积分数的影响
难度: 中等查看答案及解析
-
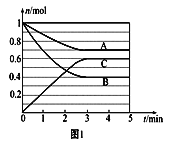
T℃时,在1L的密闭容器中充入2molCO2和6molH2,发生反应:CO2(g)+3H2(g)
CH3OH(g)+H2O(g)△H=﹣49.0kJ•mol﹣1。测得H2和CH3OH(g)的浓度随时间变化情况如图所示。下列说法不正确的是( )
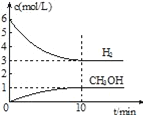
A. 0~10min内v(H2)=0.3mol•L﹣1•min﹣1
B. T℃时,平衡常数K=
,CO2与H2的转化率相等
C. T℃时,当有32gCH3OH生成时,放出49.0kJ的热量
D. 达到平衡后,升高温度或再充入CO2气体,都可以提高H2的转化率
难度: 困难查看答案及解析
-
常温下,向1L0.1mo1•L-1NH4Cl溶液中,不断加入固体NaOH后,NH4+与NH3·H2O的浓度变化趋势如图所示(不考虑溶液体积的变化和氨的挥发),下列说法正确的是( )
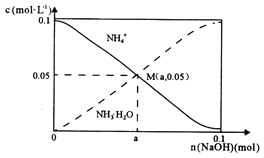
A. M点溶液中水的电离程度比原溶液大
B. 随着NaOH的加入,NH4+与NH3·H2O物质的量总量减少
C. 当n(NaOH)=0.05mol时,溶液中有:c(C1-)>c(Na+)>c(NH4+)>c(OH-)>c(H+)
D. 在M点时,n(OH-)+0.05=a+n(H+)
难度: 困难查看答案及解析
-
浓度均为0.1mol·L-1、体积均为V0的HX、HY溶液,分别加水稀释至体积V,pH随lg[V/V0]的变化关系如图所示。下列叙述正确的是( )

A. 常温下,由水电离出的c(H+)·c(OH-):a<b
B. HX、HY都是弱酸,且HX的酸性比HY的弱
C. 相同温度下,电离常数K( HX):a>b
D. lg[V/V0]=3,若同时微热两种溶液(不考虑HX、HY和H2O的挥发), 则c(X-)/c(Y-)减小
难度: 中等查看答案及解析
-
在20mL bmol·L﹣1KOH溶液中逐滴加入0.1mol·L﹣1醋酸
溶液,溶液pH和加入醋酸的体积关系曲线如图所示,下列关系不正确的是( )
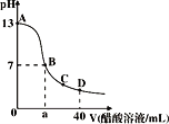
A. a=20 B. b=0.1
C. 在C点:c(CH3COO﹣)>c(K+)>c(H+)>c(OH﹣) D. 在D点:c(CH3COO﹣)+c(CH3COOH)=2c(K+)
难度: 中等查看答案及解析