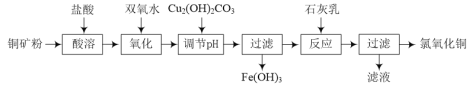
-
《可再生能源法》倡导碳资源的高效转化及循环利用。下列做法与上述理念相违背的是
A. 加快石油等化石燃料的开采和使用 B. 大力发展煤的气化及液化技术
C. 以CO2 为原料生产可降解塑料 D. 将秸秆进行加工转化为乙醇燃料
难度: 中等查看答案及解析
-
反应Cl2+2NaOH=NaCl+NaClO+H2O,可用于工业上制取漂白精。下列表示反应中相关微粒的化学用语正确的是
A.NaOH的电子式:Na:
:H
B.中子数为18的Cl原子:
Cl
C.Na的结构示意图:
D.NaClO的水解方程式:ClO-+H2O=HClO+OH-
难度: 简单查看答案及解析
-
下列有关物质的性质与用途具有对应关系的是
A.Na2SiO3易溶于水,可作木材防火剂 B.NH3呈碱性,可用作制冷剂
C.Fe粉有还原性,可用作食品抗氧化剂 D.漂白粉溶液呈无色,可用作消毒剂
难度: 简单查看答案及解析
-
室温下,下列各组离子在指定溶液中能大量共存的是
A.pH=2的溶液:Na+、Fe3+、Cl-、
B.c(NaAlO2)=0.1 mol·L-1的溶液:K+、H+、Cl-、
C.c(OH-)<
的溶液:Na+、K+、
、ClO-
D.c(Fe3+)=0.1 mol·L-1的溶液:Al3+、
、
、SCN-
难度: 简单查看答案及解析
-
短周期主族元素X、Y、Z、R、W原子序数依次增大,其原子的最外层电子数之和为22。X与Y位于同一周期,X与Z、Y与W分别位于同一主族;R最外层电子数是电子层数的2倍。下列叙述正确的是
A.五种元素中X元素的原子半径最小 B.最高正价:Y>R
C.最高价氧化物对应水化物的酸性:W>R D.最高价氧化物的水化物碱性:X>Z
难度: 中等查看答案及解析
-
在给定条件下,下列所示的物质间的转化均能实现的是
A.HClO
Cl2
FeCl3(aq) B.NO2
HNO3(aq)
Cu(NO3)2(aq)
C.SO2
CaSO3
CaSO4 D.Fe
Fe2O3
FeCl3(aq)
难度: 简单查看答案及解析
-
5—羟色胺对人体睡眠具有调节作用,其结构简式如右图所示。下列有关5—羟色胺说法正确的是
A.该有机物分子式为C11H11N2O3
B.该有机物既能和NaOH反应,也能和HCl反应
C.该有机物分子中无手性碳原子
D.1mol该物质最多可消耗溴水中2mol Br2
难度: 简单查看答案及解析
-
下列指定反应的离子方程式正确的是
A.澄清石灰水中加入过量小苏打溶液:
+Ca2++OH-=CaCO3↓+H2O
B.苯酚钠溶液中通入少量CO2:2C6H5O-+CO2+H2O ===2C6H5OH↓+
C.潮湿环境中钢铁发生电化学腐蚀的反应:Fe+2H2O=Fe(OH)2+H2↑
D.酸性溶液中KIO3与KI反应生成I2:
+5I-+6H+=3I2+3H2O
难度: 中等查看答案及解析
-
下列有关实验装置能达到实验目的是
A.制取NH3
 B.制取Cl2
B.制取Cl2
C.蒸干制AlCl3
 D.中和滴定
D.中和滴定
难度: 中等查看答案及解析
-
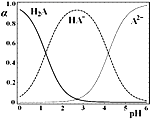
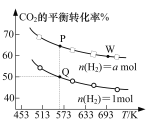
依据下列图示所得结论正确的是
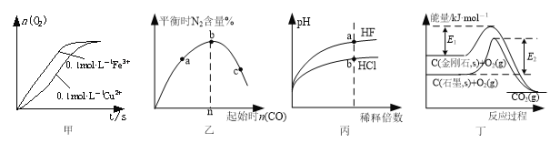
A.图甲表示向2 mL 5%的H2O2溶液中分别滴加0.1 mol·L−1 Fe3+和Cu2+(两溶液的阴离子相同)各1 mL,生成氧气的体积随时间的变化,表明Cu2+能使反应速率更快
B.图乙表示反应2CO(g)+2NO(g)
N2(g)+2CO2(g),在其他条件不变时,改变起始CO的物质的量,平衡时N2的体积分数变化,由图可知NO的转化率c>b>a
C.图丙表示常温下稀释HF和HCl时溶液的pH变化情况,由图可知a点时HF的物质的量浓度小于b点时HCl的物质的量浓度
D.图丁表示金刚石和石墨分别与O2反应过程中的能量变化情况,由图知反应C(金刚石,s)=C(石墨,s)的焓变ΔH=(E1-E2)kJ·mol-1
难度: 中等查看答案及解析
-
化合物Z是有机化工中重要中间体,其合成路线如图,下列说法正确的是
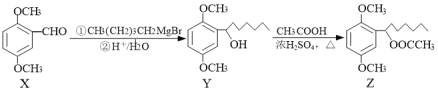
A.1mol X最多能与3mol H2发生加成反应
B.可用NaHCO3溶液鉴别反应后Z中是否含有Y
C.可用新制的Cu(OH)2溶液鉴别反应后Z中是否含有X
D.1 mol Z最多可消耗2mol NaOH
难度: 中等查看答案及解析
-
根据下列实验操作和现象所得到的结论正确的是
选项
实验操作
实验现象
结论
A
向苯和甲苯中分别滴加少量酸性KMnO4溶液,充分振荡
苯中溶液为紫红色,甲苯中溶液为无色
甲基使苯环变活泼,苯环被氧化
B
溴乙烷与 NaOH 的乙醇溶液共热,逸出的气体通入高锰酸钾溶液
溶液紫红色褪去
逸出气体含乙烯
C
向蛋白质溶液中加入饱和(NH4)2SO4溶液
出现白色沉淀
蛋白质发生了变性
D
向2mL 0.1 mol·L-1NaCl溶液中滴入1滴0.1 mol·L-1AgNO3溶液,有白色沉淀生成,再继续滴入1滴0.1 mol·L-1KI溶液
有黄色沉淀出现
Ksp[AgCl]>Ksp[AgI]
A.A B.B C.C D.D
难度: 中等查看答案及解析
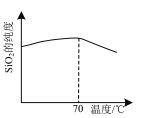
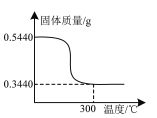
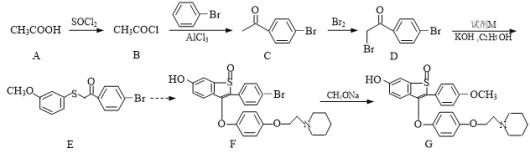
 是合成所需的原料之一,它的一种同分异构体Y同时满足下列条件,写出Y的结构简式:_______。
是合成所需的原料之一,它的一种同分异构体Y同时满足下列条件,写出Y的结构简式:_______。 。请写出以
。请写出以