-
下列说法正确的是( )
A. 漂白粉在空气中久置变质是因为漂白粉中的CaCl2与空气中的CO2反应生成CaCO3
B. 向含I-的无色溶液中滴加少量新制氯水,再滴加淀粉溶液,若溶液变成蓝色,则氧化性:Cl2>I2
C. 为测定新制氯水的pH,用玻璃棒蘸取液体滴在pH试纸上,与标准比色卡对照即可
D. 氯气溶于水的离子方程式:Cl2+H2O===2H++Cl-+ClO-
难度: 中等查看答案及解析
-
化学与人类生产生活、社会可持续发展密切相关,下列说法不正确的是
A. 利用高纯度硅制造的太阳能电池板可将光能直接转化为电能
B. “春蚕到死丝方尽,烛炬成灰泪始干”其中的“丝”和“泪”化学成分都是蛋白质
C. 施肥时,铵态氮肥不能与草木灰混合使用
D. 《本草经集注》中关于鉴别硝石(KNO3)和朴硝(Na2SO4)的记载:“以火烧之,紫青烟起,乃真硝石也”,该方法应用了焰色反应
难度: 中等查看答案及解析
-
石油通过分馏获取轻质油的产量较低,为了进一步提高轻质油的产量和质量,可以采用
A.裂解 B.减压分馏 C.催化裂化 D.常压分馏
难度: 中等查看答案及解析
-
下列表示氮原子结构的化学用语中,对核外电子运动状态描述正确且能据此确定电子能级的是( )
A.
B.
C.1s22s22p3 D.
难度: 中等查看答案及解析
-
下列说法正确的是( )
A.H2O、H2S、H2Se的分子间作用力依次增大
B.SiO2和晶体硅都是共价化合物,都是原子晶体
C.NaOH 和 K2SO4 的化学键类型和晶体类型相同
D.NaHSO4加热融化时破坏了该物质中的离子键和共价键
难度: 困难查看答案及解析
-
下列说法正确的是
A.因为 SO2具有溧白性,所以它能使品红溶液、溴水、KMnO4(H+)、石蕊溶液褪色
B.装满SO2气体的试管倒立在滴有紫色石蕊的水槽中,进入试管的液体呈红色
C. SO2、溧白粉、活性碳、Na2O2都能使红墨水褪色,其原理相同
D. SO2和C12等物质的量混合后同时通入装有湿润的有色布条的集气瓶中,漂白效果更好
难度: 困难查看答案及解析
-
在下述条件下,一定能大量共存的离子组是( )
A. c(H+)/c(OH-)=1×1014的溶液:Ca2+、Na+、ClO-、NO3-
B. 能与Al反应产生H2的溶液中:HCO3-、Na+、Al3+、Br-
C. 使甲基橙变红的溶液:K+、Fe2+、SO42-、NO3-
D. 常温下pH=1的溶液中:Mg2+、Cl-、SO42-、Fe3+
难度: 中等查看答案及解析
-
下列曲线表示F、Cl、Br元素及所形成物质的某种性质随核电荷数的变化趋势,正确的是
A.
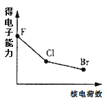 B.
B.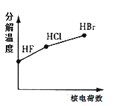 C.
C.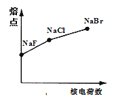 D.
D.
难度: 中等查看答案及解析
-
下列事实中,其中与盐类的水解无关的有( )
A.长期施用化肥(NH4)2SO4会使土壤酸性增大,发生板结
B.NaHSO4溶液呈酸性
C.氯化铵溶液可除去金属制品表面的锈斑
D..配制AgNO3溶液,用稀硝酸溶解AgNO3固体
难度: 中等查看答案及解析
-
海洋中无机氮的循环过程可用如图表示。下列说法正确的是(已知:反应④的离子方程式为4NH4+ + 5O2
2NO2- + 6H+ + N2O + 5H2O)
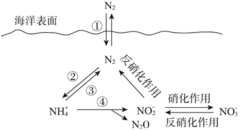
A. ①②均属于固氮反应
B. 海洋中的反硝化作用一定需要氧气参加
C. 反应④中每生成1 mol H2O转移2 mol e-
D. 向海洋排放含NO3-的废水可能影响海洋中氮的循环
难度: 中等查看答案及解析
-
如图,将一根较纯的铁棒垂直没入水中,由于深水处溶氧量较少,一段时间后发现AB段产生较多铁锈,BC段腐蚀严重。下列关于此现象的说法错误的是( )
A.该腐蚀过程属于电化腐蚀
B.铁棒AB段电极反应为O2 + 2H2O+ 4e-→ 4OH-
C.铁棒AB段是负极,BC段是正极
D.产生此现象的根本原因是铁棒所处化学环境的不同
难度: 简单查看答案及解析
-
向等物质的量浓度的Ba(OH)2 与BaCl2 的混合溶液中加入NaHCO3 溶液,下列离子方程式与事实相符的是( )
A.HCO3-+OH- =CO32-+H2O
B.Ba2++OH-+HCO3-=BaCO3↓+H2O
C.Ba2++2OH-+2HCO3-=BaCO3↓+CO32-+H2O
D.2Ba2++3OH-+3HCO3-=2BaCO3↓+CO32-+3H2O
难度: 中等查看答案及解析
-
丙烷的分子结构可简写成键线式结构
,有机物A的键线式结构为
,有机物B与等物质的量的H2发生加成反应可得到有机物A。下列有关说法错误的是( )
A.有机物A的一氯取代物只有4种
B.用系统命名法命名有机物A,名称为2,2,3−三甲基戊烷
C.有机物A的分子式为C8H18
D.B的结构可能有3种,其中一种名称为3,4,4−三甲基−2−戊烯
难度: 简单查看答案及解析
-
如图,向烧杯中滴加几滴浓盐酸,CaCO3 固体还有剩余(忽略体积、温度的变化),下列数值变小的是( )

A. c(Ca 2 ) B. c(CO32 ) C. c(H ) D. 碳酸钙的溶解度
难度: 困难查看答案及解析
-
下列根据实验操作和现象所得出的结论正确的是( )
选项
实验操作
实验现象
结论
A
等体积
的
和
两种酸分别与足量的锌反应
相同时间内
与
反应生成的氢气更多
是强酸
B
将湿润的淀粉-
试纸分别放入
和
蒸气中
试纸只在
蒸气中变蓝色
氧化性:
C
将光亮的镁条放入盛有
溶液的试管中
有大量气泡产生
生成的气体是
D
向 NaHCO3溶液中加入NaAlO2溶液
有白色沉淀生成
结合
的能力比
强
A. A B. B C. C D. D
难度: 困难查看答案及解析
-
下列图示与对应的叙述不相符的是( )
A.
 四种基本反应类型与氧化还原反应的关系
四种基本反应类型与氧化还原反应的关系B.
 AlCl3溶液中滴加NaOH溶液生成沉淀的情况
AlCl3溶液中滴加NaOH溶液生成沉淀的情况C.
 Ba(OH)2溶液中滴加硫酸溶液导电性的情况
Ba(OH)2溶液中滴加硫酸溶液导电性的情况D.
 等体积、等浓度稀硫酸分别与足量铁和镁反应的情况
等体积、等浓度稀硫酸分别与足量铁和镁反应的情况难度: 困难查看答案及解析
-
在杠杆的两端分别挂着质量和体积都相同的铝球和铁球,此时杠杆平衡。然后将两球分别浸没在氢氧化钠溶液和硫酸铜溶液中片刻,则下列说法正确的是( )
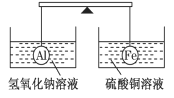
A.两烧杯中均无气泡产生 B.去掉两烧杯,杠杆右端下沉
C.去掉两烧杯,杠杆仍平衡 D.左边烧杯中的溶液质量减少了
难度: 中等查看答案及解析
-
常温下,将100 mL 1 mol·L-1的氨水与100 mL a mol·L-1盐酸等体积混合,忽略反应放热和体积变化,下列有关推论不正确的是
A. 若混合后溶液pH=7,则c(NH4+)=c(Cl-)
B. 若a=2,则c(Cl-)>c(NH4+)>c(H+)>c(OH-)
C. 若a=0.5,则c(NH4+)>c(Cl-)>c(OH-)>c(H+)
D. 若混合后溶液满足c(H+)=c(OH-)+c(NH3·H2O),则可推出a=1
难度: 困难查看答案及解析
-
对下列各溶液中,微粒的物质的量浓度关系表述正确的是( )
A.0.1 mol/L的(NH4)2SO4溶液中:c(SO42-)>c(NH4+)>c(H+)>c(OH-)
B.0.1 mol/L的NaHCO3溶液中:c(Na+)=c(HCO3-)+c(H2CO3)+2c(CO32-)
C.将0.2 mol/L NaA溶液和0.1 mol/L盐酸等体积混合所得碱性溶液中:c(Na+)+c(H+)=c(A-)+c(Cl-)
D.在25℃0.1 mol/L的 NH4Cl溶液中:c(Cl-)=c(NH4+)+c(NH3·H2O)
难度: 困难查看答案及解析
-
Na2CO3固体中可能含有杂质K2CO3、NaHCO3、NaCl中的一种或几种,取10g样品,加入一定量的稀盐酸产生气体4.4g,下列分析正确的是( )
A.一定含有NaHCO3 B.一定含有K2CO3
C.可能含有NaHCO3 D.一定含有NaCl
难度: 中等查看答案及解析
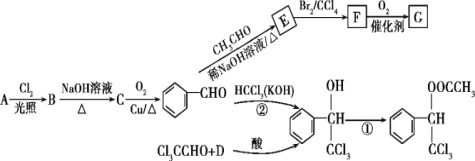
 是一种重要的药物中间体,其合成路线与G相似,请以
是一种重要的药物中间体,其合成路线与G相似,请以