-
利用反应NO2(g)+SO2(g) SO3(g)+NO(g)+Q(Q>0)可处理NO2、SO2等大气污染物,具有十分重要的意义。
SO3(g)+NO(g)+Q(Q>0)可处理NO2、SO2等大气污染物,具有十分重要的意义。
完成下列填空。
(1)该反应中被氧化的元素是_____;写出该反应的平衡常数表达式:K=_____。
(2)若将NO2(g)和SO2(g)置于一密闭容器中进行上述反应。下列说法能表明反应达到平衡状态的是______(选填编号)。
a.混合气体颜色保持不变 b.NO2和NO的体积比保持不变
c.每消耗1mol SO2的同时生成1mol SO3 d.体系中气体密度保持不变
(3)一定温度下,在容积为V L的容器中发生上述反应,t min内,SO2的物质的量下降了a mol,则这段时间内v(NO)=_______(用相关字母表示并注明单位)。
(4)请写出两种能提高SO2转化率的措施:_________。
(5)亚硫酸溶液久置,pH会变小,请用化学方程式表示其原因___。
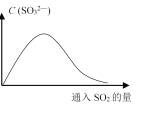
(6)将SO2持续通入NaOH溶液中,溶液中SO32-的浓度变化如图所示,请解释原因。__________。
-
利用反应NO2(g)+SO2(g) SO3(g)+NO(g)+Q(Q>0)可处理NO2、SO2等大气污染物,具有十分重要的意义。
SO3(g)+NO(g)+Q(Q>0)可处理NO2、SO2等大气污染物,具有十分重要的意义。
完成下列填空。
(1)该反应中被氧化的元素是_____;写出该反应的平衡常数表达式:K=_____。
(2)若将NO2(g)和SO2(g)置于一密闭容器中进行上述反应。下列说法能表明反应达到平衡状态的是______(选填编号)。
a.混合气体颜色保持不变 b.NO2和NO的体积比保持不变
c.每消耗1mol SO2的同时生成1mol SO3 d.体系中气体密度保持不变
(3)一定温度下,在容积为V L的容器中发生上述反应,t min内,SO2的物质的量下降了a mol,则这段时间内v(NO)=_______(用相关字母表示并注明单位)。
(4)请写出两种能提高SO2转化率的措施:_________。
(5)亚硫酸溶液久置,pH会变小,请用化学方程式表示其原因___。
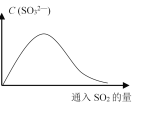
(6)将SO2持续通入NaOH溶液中,溶液中SO32-的浓度变化如图所示,请解释原因。__________。
-
利用反应NO2(g)+SO2(g) SO3(g)+NO(g) △H=-Q kJ/mol(Q>0)可处理NO2、SO2等大气污染物,具有十分重要的意义。完成下列填空:
SO3(g)+NO(g) △H=-Q kJ/mol(Q>0)可处理NO2、SO2等大气污染物,具有十分重要的意义。完成下列填空:
(1)该反应中被氧化是元素是_________;写出该反应的平衡常数表达式:K=_________。增大NO2浓度,平衡常数K_________。(填“增大”、“减小”或“不变”)
(2)若上述反应在密闭容器中进行,能表明反应达到平衡状态的是_________(选填编号)。
a. 混合气体颜色保持不变 b. NO2和NO的体积比保持不变
c. 每消耗1 mol SO2的同时生成1 mol SO3 d. 体系中气体平均摩尔质量保持不变
(3)一定温度下,在容积为V L的容器中发生上述反应,t min内,SO2的物质的量下降了a mol,则这段时间内v(NO2)=_________(用相关字母表示)。
(4)请写出两种能提高平衡转化率的措施____________、______________。
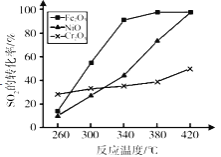
(5)其他条件相同,催化剂不同时,上述反应中SO2的转化率随反应温度的变化如图。不考虑催化剂价格因素,生产中选择Fe2O3作催化剂的主要原因是___________
-
利用反应NO2(g)+SO2(g) SO3(g)+NO(g)+Q(Q>0)可处理NO2、SO2等大气污染物,具有十分重要的意义。
SO3(g)+NO(g)+Q(Q>0)可处理NO2、SO2等大气污染物,具有十分重要的意义。
完成下列填空:
(1)该反应中被氧化的元素是__________;写出该反应的平衡常数表达式:K =_____________。
(2)若上述反应在一密闭容器中进行。下列能表明反应达到平衡状态的是_______(选填编号)。
a.混合气体颜色保持不变
b.NO2和NO的体积比保持不变
c.每消耗1mol SO2的同时生成1mol SO3
d.体系中气体密度保持不变
(3)一定温度下,在容积为V L的容器中发生上述反应,t min内,SO2的物质的量下降了a mol,则这段时间内v(NO) =__________(用相关字母表示并注明单位)。
(4)请写出两种能提高SO2转化率的措施:_____________、_____________。
(5)亚硫酸溶液久置,pH会变小,请用方程式表示其原因_______________
(6)将SO2持续通入NaOH溶液中,溶液中SO32—的浓度变化如图所示,请解释原因。
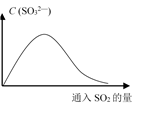
__________________
-
研究NO2、SO2、CO等大气污染气体的处理及利用的方法具有重要意义。
(1)一定条件下,NO2与SO2反应生成SO3和NO两种气体。将体积比为1∶2的NO2、SO2气体置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是____________(填字母)。
a. 体系压强保持不变
b. 混合气体颜色保持不变
c. 体系中SO3的体积分数保持不变
d. 每消耗1 mol SO2的同时生成1 mol NO
测得上述反应平衡时NO2与SO2体积比为1∶6,则平衡常数K=____________。
(2)新型氨法烟气脱硫技术的化学原理是采用氨水吸收烟气中的SO2,再用一定量的磷酸与上述吸收产物反应。该技术的优点除了能回收利用SO2外,还能得到一种复合肥料,该复合肥料可能的化学式为________(写出一种即可)。
(3)右图是MCFC燃料电池,它是以水煤气(CO、H2)为燃料,一定比例Li2CO3和Na2CO3低熔混合物为电解质。A为电池的________(填“正”或“负”)极,写出B极电极反应式:________________________。
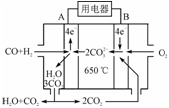
(4)工业上常用Na2CO3溶液吸收法处理氮的氧化物(以NO和NO2的混合物为例)。
已知:NO不能与Na2CO3溶液反应。
NO+NO2+Na2CO3===2NaNO2+CO2
2NO2+Na2CO3===NaNO2+NaNO3+CO2
① 用足量的Na2CO3溶液完全吸收NO和NO2的混合物,每产生22.4 L(标准状况)CO2(全部逸出)时,吸收液质量就增加44 g,则混合气体中NO和NO2的体积比为__________。
② 用Na2CO3溶液吸收法处理氮的氧化物存在的缺点是____________。
-
研究NO2、SO2、CO等大气污染气体的处理及利用的方法具有重要意义。
⑴一定条件下,NO2与SO2反应生成SO3和NO两种气体。将体积比为1∶2的NO2、SO2气体置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是________(填字母)。
a.体系压强保持不变 b.混合气体颜色保持不变
c.体系中SO3的体积分数保持不变 d.每消耗1 mol SO2的同时生成1 mol NO
测得上述反应平衡时NO2与SO2体积比为1∶6,则平衡常数K=________。
⑵新型氨法烟气脱硫技术的化学原理是采用氨水吸收烟气中的SO2,再用一定量的磷酸与上述吸收产物反应。该技术的优点除了能回收利用SO2外,还能得到一种复合肥料,该复合肥料可能的化学式为________(写出一种即可)。
⑶右图是MCFC燃料电池,它是以水煤气(CO、H2)为燃料,一定比例Li2CO3和Na2CO3低熔混合物为电解质。A为电池的________(填“正”或“负”)极,写出B极电极反应式:________________________。
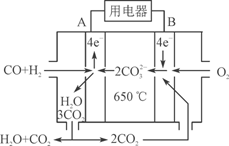
⑷工业上常用Na2CO3溶液吸收法处理氮的氧化物(以NO和NO2的混合物为例)。
已知:NO不能与Na2CO3溶液反应。
NO+NO2+Na2CO3=2NaNO2+CO2
2NO2+Na2CO3=NaNO2+NaNO3+CO2
①用足量的Na2CO3溶液完全吸收NO和NO2的混合物,每产生22.4 L(标准状况)CO2(全部逸出)时,吸收液质量就增加44 g,则混合气体中NO和NO2的体积比为
____________。
②用Na2CO3溶液吸收法处理氮的氧化物存在的缺点是____________。
-
NOx、SO2、CO等大气污染物的处理及利用在工业上具有重要意义。
(l)一定条件下,NO2 与SO2反应生成SO3和NO两种气体。将体积比为l: 1 的NO2 和SO2气体置于恒容密闭容器中发生上述反应,下列能说明该反应达到化学平衡状态的是____(填字母)。
a.混合气休平均摩尔质量不变 b.混合气休颜色保持不变
c.每消耗1 molSO2的同时生成1 mol NO d.容器内的气体密度不变
(2)燃煤锅炉将排放大量SO2,污染大气造成公害,常采用下列两种方法消除燃煤SO2的污染。使排放的烟气通过足量的浓氨水洗涤,化学方程式是_________。在煤中加适量生石灰,使SO2 与生石灰反应,化学方程式为_______。
(3)工业处理CO的其中一种方法是利用H2O(g)+ CO(g) H2(g)+CO2(g)△H<0来制备氢气。已知在恒容体系内发生此反应,某温度下该反应的平衡常数K=1。若起始时c(CO)= l mol/L,c(H2O)= 2 mol/L。
H2(g)+CO2(g)△H<0来制备氢气。已知在恒容体系内发生此反应,某温度下该反应的平衡常数K=1。若起始时c(CO)= l mol/L,c(H2O)= 2 mol/L。
试回答下列问题:
① 该温度下,反应进行一段时间后,测得H2O的浓度为1.6 mol/L ,则此时该反应v (正)___ v(逆)(填“>”“<”或“=”);若在平衡建立之后,向体系内通入一定量的Ar, H2的平衡产率将____(填“增大”“减小”或“不变”)。
② 上述反应生成的H2与CO2可以设计成原电池来合成CH3OH,装置如图所示:
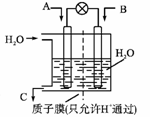
若A为CO2, B为H2 , C 为CH3OH,则通入CO2的一极为_____极;
若A改为SO2, B为O2, C 为H2SO4,则正极的电极反应式为____________。
(4)已知在催化转化装置内,汽车尾气中的NO、CO能发生如下反应:
2NO(g)+2CO(g)  N2(g)+2CO2(g) △H=-746.8KJ/mol, 利用传感器记录某温度下上述反应的进程,测量所得数据如图。已知达到平衡时NO的转化率为80%,则该反应的平衡常数为____(保留小数点后一位小数)
N2(g)+2CO2(g) △H=-746.8KJ/mol, 利用传感器记录某温度下上述反应的进程,测量所得数据如图。已知达到平衡时NO的转化率为80%,则该反应的平衡常数为____(保留小数点后一位小数)
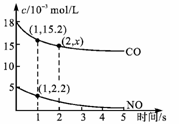
-
研究NO2、SO2、CO等大气污染气体的处理具有重要意义。
I. 利用反应:6NO2 + 8NH3 7N2 + 12 H2O处理NO2。
7N2 + 12 H2O处理NO2。
II. 一定条件下NO2与SO2可发生反应:NO2(g)+SO2(g) SO3(g)+NO(g) −Q (Q>0) 。
SO3(g)+NO(g) −Q (Q>0) 。
III. CO可用于合成甲醇,反应方程式为:CO(g) + 2H2(g) CH3OH(g) 。
CH3OH(g) 。
(1)硫离子最外层电子的电子排布式为__________________,氨气分子的电子式为___________,氨气分子属于___________分子(填“极性”或者“非极性”)。
(2)C、O、S、N这四种元素中属于同周期元素的非金属性由强到弱的顺序为_______________,能证明其递变规律的事实是(________)
a、最高价氧化物对应水化物的酸性 b、气态氢化物的沸点
c、单质与氢气反应的难易程度 d、其两两组合形成的化合物中元素的化合价
(3)对于I中的反应,120℃时,该反应在一容积为2L的容器内反应,20min时达到平衡,10min时电子转移了1.2mol,则0~10min时,平均反应速率υ(NO2) =_______________。
(4)对于II中的反应,将NO2与SO2以体积比1:2置于密闭容器中反应,下列能说明反应达到平衡状态的是_____________
a. 体系压强保持不变 b. NO2浓度保持不变
c. NO2和SO3的体积比保持不变 d. 混合气体的平均相对分子质量保持不变
(5)请写出II中反应的平衡常数表达式K=_____________________________________。如果II中反应的平衡常数K值变大,该反应___________
a.一定向正反应方向移动 b. 平衡移动时,正反应速率先减小后增大
c.一定向逆反应方向移动 d. 平衡移动时,逆反应速率先增大后减小
(6)对于III中的反应,CO在不同温度下的平衡转化率与压强的关系如图示。实际生产条件控制在250℃、1.3×104 kPa左右,简述选择此压强的理由:____________________________。
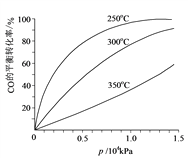
-
(12分)研究NO2、SO2 、CO等大气污染气体的处理具有重要意义。
(1)NO2可用水吸收,相应的化学反应方程式为 。利用反应6NO2+ 8NH3 7N5+12 H2O也可处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是 L。
7N5+12 H2O也可处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是 L。
(2)已知:2SO2(g)+O2(g) 2SO3(g) ΔH=-196.6 kJ·mol-1
2SO3(g) ΔH=-196.6 kJ·mol-1
2NO(g)+O2(g) 2NO2(g) ΔH=-113.0 kJ·mol-1
2NO2(g) ΔH=-113.0 kJ·mol-1
则反应NO2(g)+SO2(g) SO3(g)+NO(g)的ΔH= kJ·mol-1。
SO3(g)+NO(g)的ΔH= kJ·mol-1。
一定条件下,将NO2与SO2以体积比1:2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是 。
a.体系压强保持不变
b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变
d.每消耗1 mol SO3的同时生成1 molNO2
(3)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g) CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如下图所示。该反应ΔH 0(填“>”或“ <”)。实际生产条件控制在250℃、1.3×104kPa左右,选择此压强的理由是 。
CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如下图所示。该反应ΔH 0(填“>”或“ <”)。实际生产条件控制在250℃、1.3×104kPa左右,选择此压强的理由是 。
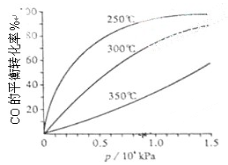
-
研究NO2、SO2 、CO等大气污染气体的处理具有重要意义。
(1)NO2可用水吸收,相应的化学反应方程式为________。利用反应6NO2+ 
 7N5+12 H2O也可处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是________L。
7N5+12 H2O也可处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是________L。
(2)已知:2SO2(g)+O2(g) 2SO3(g) ΔH=-196.6 kJ·mol-1
2SO3(g) ΔH=-196.6 kJ·mol-1
2NO(g)+O2(g) 2NO2(g) ΔH=-113.0 kJ·mol-1
2NO2(g) ΔH=-113.0 kJ·mol-1
则反应NO2(g)+SO2(g) SO3(g)+NO(g)的ΔH=________kJ·mol-1。
SO3(g)+NO(g)的ΔH=________kJ·mol-1。
一定条件下,将NO2与SO2以体积比1:2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是________。
a.体系压强保持不变
b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变
d.每消耗1 mol SO3的同时生成1 mol NO2
测得上述反应平衡时NO2与SO2体积比为1:6,则平衡常数K=________。
(3)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g) CH3OH(g)。
CH3OH(g)。
CO在不同温度下的平衡转化率与压强的关系如图所示。该反应ΔH________0(填“>”或“ <”)。实际生产条件控制在250℃、1.3×104kPa左右,选择此压强的理由是________。
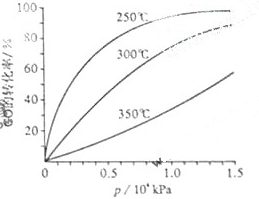
SO3(g)+NO(g)+Q(Q>0)可处理NO2、SO2等大气污染物,具有十分重要的意义。










