-
利用反应NO2(g)+SO2(g) SO3(g)+NO(g) △H=-Q kJ/mol(Q>0)可处理NO2、SO2等大气污染物,具有十分重要的意义。完成下列填空:
SO3(g)+NO(g) △H=-Q kJ/mol(Q>0)可处理NO2、SO2等大气污染物,具有十分重要的意义。完成下列填空:
(1)该反应中被氧化是元素是_________;写出该反应的平衡常数表达式:K=_________。增大NO2浓度,平衡常数K_________。(填“增大”、“减小”或“不变”)
(2)若上述反应在密闭容器中进行,能表明反应达到平衡状态的是_________(选填编号)。
a. 混合气体颜色保持不变 b. NO2和NO的体积比保持不变
c. 每消耗1 mol SO2的同时生成1 mol SO3 d. 体系中气体平均摩尔质量保持不变
(3)一定温度下,在容积为V L的容器中发生上述反应,t min内,SO2的物质的量下降了a mol,则这段时间内v(NO2)=_________(用相关字母表示)。
(4)请写出两种能提高平衡转化率的措施____________、______________。
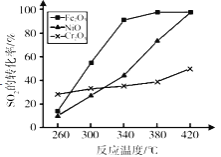
(5)其他条件相同,催化剂不同时,上述反应中SO2的转化率随反应温度的变化如图。不考虑催化剂价格因素,生产中选择Fe2O3作催化剂的主要原因是___________
-
Ⅰ.研究NO2、SO2、CO等大气污染气体的处理具有重要意义.
(1)已知:2SO2(g)+O2(g)⇌2SO3(g)△H=-Q1kJ•mol-1
2NO(g)+O2(g)⇌2NO2(g)△H=-Q2kJ•mol-1
则反应NO2(g)+SO2(g)⇌SO3(g)+NO(g) 的△H=______kJ•mol-1.
(2)一定条件下,将NO2与SO2以体积比1:2置于密闭容器中发生上述反应,当测得上述反应平衡时NO2与NO体积比为1:3,则平衡常数K=______.
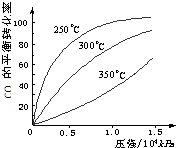
(3)CO可用于合成甲醇,反应方程式为:CO(g)+2H2(g)⇌CH3OH(g).CO在不同温度下的平衡转化率与压强的关系如图所示.该反应△H______0(填“>”或“<”).
Ⅱ.已知草酸是一种二元弱酸,草酸氢钠(NaHC2O4)溶液显酸性.
(1)用离子方程式解释Na2C2O4溶液显碱性的原因______;
(2)常温下,比较0.1mol•L-1NaHC2O4溶液中各种离子浓度的大小关系______;
Ⅲ.某课外活动小组为了探究的BaSO4溶解度,分别将足量BaSO4放入:a.5ml 水;b.40ml 0.2mol•L-1的Ba(OH)2溶液;c.20ml 0.5mol•L-1的Na2SO4溶液;d.40ml 0.1mol•L-1的H2SO4溶液中,溶解至饱和.
(1)以上各溶液中,的浓度由大到小的顺序为______;
A.b>a>c>d B.b>a>d>c C.a>d>c>b D.a>b>d>c
(2)某同学取同样的溶液b和溶液d直接混合,则混合溶液的pH值为______(设混合溶液的体积为混合前两溶液的体积之和).
-
研究NO2、SO2 、CO等大气污染气体的处理具有重要意义。
(1)已知:2SO2(g)+O2(g) 2SO3(g) ΔH=-196.6 kJ·mol—1,2NO(g)+O2(g)
2SO3(g) ΔH=-196.6 kJ·mol—1,2NO(g)+O2(g) 2NO2(g) ΔH=-113.0 kJ·mol—1,则反应:NO2(g)+SO2(g)
2NO2(g) ΔH=-113.0 kJ·mol—1,则反应:NO2(g)+SO2(g) SO3(g)+NO(g)的ΔH= kJ·mol—1
SO3(g)+NO(g)的ΔH= kJ·mol—1
(2)利用反应6NO2+ 8NH3  7N2+12H2O可处理NO2。一定条件下,将该反应设计成如右图所示装置,其中电极均为石墨,使用熔融金属氧化物作电解质,写出负极电极反应式 ;若一段时间内测得外电路中有1.2mol电子通过,则两极共产生的气体产物在标准状况下的体积为 L。
7N2+12H2O可处理NO2。一定条件下,将该反应设计成如右图所示装置,其中电极均为石墨,使用熔融金属氧化物作电解质,写出负极电极反应式 ;若一段时间内测得外电路中有1.2mol电子通过,则两极共产生的气体产物在标准状况下的体积为 L。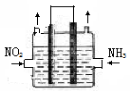
(3)一定条件下,将NO2与SO2以体积比1︰2置于恒容密闭容器中发生下述反应:NO2(g)+SO2(g) SO3(g)+NO(g),下列能说明该反应达到平衡状态的是 。
SO3(g)+NO(g),下列能说明该反应达到平衡状态的是 。
a.体系压强保持不变 b.混合气体颜色保持不变
c.SO3和NO的物质的量比保持不变 d.每消耗1 mol SO3的同时生成1 molNO2
(4)CO可用于合成甲醇,反应方程式为:CO(g)+2H2(g) CH3OH(g)。一定温度下,向容积为2L的密闭容器中充入2molCO和2molH2发生上述
CH3OH(g)。一定温度下,向容积为2L的密闭容器中充入2molCO和2molH2发生上述 反应,5min后反应平衡,此时测得CH3OH的浓度为0.3mol/L,计算反应开始至平衡时的平均速率v(H2)= ;该温度下反应的平衡常数为 (保留两位小数)。
反应,5min后反应平衡,此时测得CH3OH的浓度为0.3mol/L,计算反应开始至平衡时的平均速率v(H2)= ;该温度下反应的平衡常数为 (保留两位小数)。
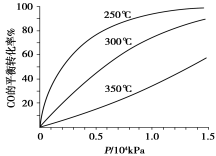
(5)不同温度CO的平衡转化率与压强的关系如上图所示。该反应ΔH 0(填“>”或“ <”)。实际生产条件控制在250℃、1.3×104kPa左右,选择此压强的理由是 。
-
研究NO2、SO2、CO等大气污染气体的处理具有重要意义。
(1)已知:Ⅰ.2SO2(g) + O2(g) 2SO3(g)ΔH=-196.6 kJ· mol-1
2SO3(g)ΔH=-196.6 kJ· mol-1
Ⅱ.2NO(g) + O2(g)  2NO2(g)ΔH=-113.0 kJ· mol-1
2NO2(g)ΔH=-113.0 kJ· mol-1
则反应NO2(g)+SO2(g) SO3(g)+NO(g)的ΔH=____kJ· mol-1。
SO3(g)+NO(g)的ΔH=____kJ· mol-1。
(2)一定条件下,将NO2(g)与SO2(g)以体积比2∶1置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是____。
A.体系压强保持不变 B.混合气体颜色保持不变
C.SO3和NO的体积比保持不变 D.每消耗1 mol SO3的同时生成1 mol NO
(3)CO可用于合成甲醇,化学方程式为CO(g)+2H2(g) CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如图甲所示,该反应的ΔH____0(填“>”或“<”)。
CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如图甲所示,该反应的ΔH____0(填“>”或“<”)。
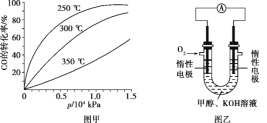
(4)依据燃烧的反应原理,合成的甲醇可以设计成如图乙所示的原电池装置。
①该电池工作时,OH-向____(填“正”或“负”)极移动。
②该电池正极的电极反应式为___________。
-
雾霾天气给人们的出行带来了极大的不便,因此研究NO2、SO2等大气污染物的处理具有重要意义。
(1)某温度下,已知:
①2SO2(g)+O2(g) 2SO3(g) △H1=-196.6kJ/mol
2SO3(g) △H1=-196.6kJ/mol
②2NO(g)+O2(g) 2NO2(g)△H2
2NO2(g)△H2
③NO2(g)+SO2(g) SO3(g)+NO(g) △H3=-41.8kJ/mol
SO3(g)+NO(g) △H3=-41.8kJ/mol
则△H2= _____________。
(2)按投料比2:1把SO2和O2加入到一密闭容器中发生反应2SO2(g)+O2(g) 2SO3(g) ,测得平衡时SO2的转化率与温度T、压强p的关系如图甲所示:
2SO3(g) ,测得平衡时SO2的转化率与温度T、压强p的关系如图甲所示:
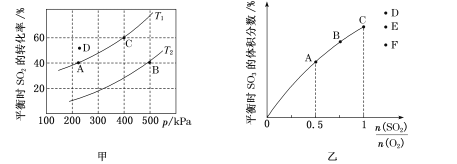
①A、B两点对应的平衡常数大小关系为KA __________(填“>”“<”或“=”,下同)KB;温度为T,时D点vD正与vD逆的大小关系为vD正 _____________vD逆;
②T1温度下平衡常数Kp=______________ kPa-1(Kp为以分压表示的平衡常数,结果保留分数形式)。
(3)恒温恒容下,对于反应2SO2(g)+O2(g) 2SO3(g),测得平衡时SO3的体积分数与起始
2SO3(g),测得平衡时SO3的体积分数与起始 的关系如图乙所示,则当
的关系如图乙所示,则当 =1.5达到平衡状态时,SO2的体积分数是图乙中D、E、F三点中的____________点。A、B两点SO2转化率的大小关系为aA ___(填“>”“<”或“=”)aB。
=1.5达到平衡状态时,SO2的体积分数是图乙中D、E、F三点中的____________点。A、B两点SO2转化率的大小关系为aA ___(填“>”“<”或“=”)aB。
(4)工业上脱硫脱硝还可采用电化学法,其中的一种方法是内电池模式(直接法),烟气中的组分直接在电池液中被吸收及在电极反应中被转化,采用内电池模式将SO2吸收在电池液中,并在电极反应中氧化为硫酸,在此反应过程中可得到质量分数为40%的硫酸。写出通入SO2电极的反应式:____________;若40%的硫酸溶液吸收氨气获得(NH4)2SO4的稀溶液,测得常温下,该溶液的pH=5,则 ___________(计算结果保留一位小数,已知该温度下NH3·H2O的Kb=1.7×10-5);若将该溶液蒸发掉一部分水后恢复室温,则
___________(计算结果保留一位小数,已知该温度下NH3·H2O的Kb=1.7×10-5);若将该溶液蒸发掉一部分水后恢复室温,则 的值将_____(填“变大”“不变”或“变小”)。
的值将_____(填“变大”“不变”或“变小”)。
-
利用反应NO2(g)+SO2(g) SO3(g)+NO(g)+Q(Q>0)可处理NO2、SO2等大气污染物,具有十分重要的意义。
SO3(g)+NO(g)+Q(Q>0)可处理NO2、SO2等大气污染物,具有十分重要的意义。
完成下列填空。
(1)该反应中被氧化的元素是_____;写出该反应的平衡常数表达式:K=_____。
(2)若将NO2(g)和SO2(g)置于一密闭容器中进行上述反应。下列说法能表明反应达到平衡状态的是______(选填编号)。
a.混合气体颜色保持不变 b.NO2和NO的体积比保持不变
c.每消耗1mol SO2的同时生成1mol SO3 d.体系中气体密度保持不变
(3)一定温度下,在容积为V L的容器中发生上述反应,t min内,SO2的物质的量下降了a mol,则这段时间内v(NO)=_______(用相关字母表示并注明单位)。
(4)请写出两种能提高SO2转化率的措施:_________。
(5)亚硫酸溶液久置,pH会变小,请用化学方程式表示其原因___。
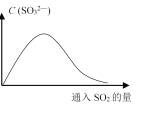
(6)将SO2持续通入NaOH溶液中,溶液中SO32-的浓度变化如图所示,请解释原因。__________。
-
利用反应NO2(g)+SO2(g) SO3(g)+NO(g)+Q(Q>0)可处理NO2、SO2等大气污染物,具有十分重要的意义。
SO3(g)+NO(g)+Q(Q>0)可处理NO2、SO2等大气污染物,具有十分重要的意义。
完成下列填空。
(1)该反应中被氧化的元素是_____;写出该反应的平衡常数表达式:K=_____。
(2)若将NO2(g)和SO2(g)置于一密闭容器中进行上述反应。下列说法能表明反应达到平衡状态的是______(选填编号)。
a.混合气体颜色保持不变 b.NO2和NO的体积比保持不变
c.每消耗1mol SO2的同时生成1mol SO3 d.体系中气体密度保持不变
(3)一定温度下,在容积为V L的容器中发生上述反应,t min内,SO2的物质的量下降了a mol,则这段时间内v(NO)=_______(用相关字母表示并注明单位)。
(4)请写出两种能提高SO2转化率的措施:_________。
(5)亚硫酸溶液久置,pH会变小,请用化学方程式表示其原因___。
(6)将SO2持续通入NaOH溶液中,溶液中SO32-的浓度变化如图所示,请解释原因。__________。
-
利用反应NO2(g)+SO2(g) SO3(g)+NO(g)+Q(Q>0)可处理NO2、SO2等大气污染物,具有十分重要的意义。
SO3(g)+NO(g)+Q(Q>0)可处理NO2、SO2等大气污染物,具有十分重要的意义。
完成下列填空:
(1)该反应中被氧化的元素是__________;写出该反应的平衡常数表达式:K =_____________。
(2)若上述反应在一密闭容器中进行。下列能表明反应达到平衡状态的是_______(选填编号)。
a.混合气体颜色保持不变
b.NO2和NO的体积比保持不变
c.每消耗1mol SO2的同时生成1mol SO3
d.体系中气体密度保持不变
(3)一定温度下,在容积为V L的容器中发生上述反应,t min内,SO2的物质的量下降了a mol,则这段时间内v(NO) =__________(用相关字母表示并注明单位)。
(4)请写出两种能提高SO2转化率的措施:_____________、_____________。
(5)亚硫酸溶液久置,pH会变小,请用方程式表示其原因_______________
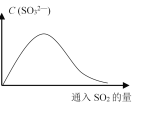
(6)将SO2持续通入NaOH溶液中,溶液中SO32—的浓度变化如图所示,请解释原因。
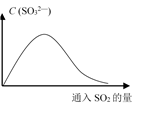
__________________
-
研究NO2、SO2、CO等大气污染气体的处理及利用的方法具有重要意义。
(1)一定条件下,NO2与SO2反应生成SO3和NO两种气体。将体积比为1∶2的NO2、SO2气体置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是____________(填字母)。
a. 体系压强保持不变
b. 混合气体颜色保持不变
c. 体系中SO3的体积分数保持不变
d. 每消耗1 mol SO2的同时生成1 mol NO
测得上述反应平衡时NO2与SO2体积比为1∶6,则平衡常数K=____________。
(2)新型氨法烟气脱硫技术的化学原理是采用氨水吸收烟气中的SO2,再用一定量的磷酸与上述吸收产物反应。该技术的优点除了能回收利用SO2外,还能得到一种复合肥料,该复合肥料可能的化学式为________(写出一种即可)。
(3)右图是MCFC燃料电池,它是以水煤气(CO、H2)为燃料,一定比例Li2CO3和Na2CO3低熔混合物为电解质。A为电池的________(填“正”或“负”)极,写出B极电极反应式:________________________。
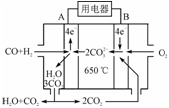
(4)工业上常用Na2CO3溶液吸收法处理氮的氧化物(以NO和NO2的混合物为例)。
已知:NO不能与Na2CO3溶液反应。
NO+NO2+Na2CO3===2NaNO2+CO2
2NO2+Na2CO3===NaNO2+NaNO3+CO2
① 用足量的Na2CO3溶液完全吸收NO和NO2的混合物,每产生22.4 L(标准状况)CO2(全部逸出)时,吸收液质量就增加44 g,则混合气体中NO和NO2的体积比为__________。
② 用Na2CO3溶液吸收法处理氮的氧化物存在的缺点是____________。
-
研究NO2、SO2、CO等大气污染气体的处理及利用的方法具有重要意义。
⑴一定条件下,NO2与SO2反应生成SO3和NO两种气体。将体积比为1∶2的NO2、SO2气体置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是________(填字母)。
a.体系压强保持不变 b.混合气体颜色保持不变
c.体系中SO3的体积分数保持不变 d.每消耗1 mol SO2的同时生成1 mol NO
测得上述反应平衡时NO2与SO2体积比为1∶6,则平衡常数K=________。
⑵新型氨法烟气脱硫技术的化学原理是采用氨水吸收烟气中的SO2,再用一定量的磷酸与上述吸收产物反应。该技术的优点除了能回收利用SO2外,还能得到一种复合肥料,该复合肥料可能的化学式为________(写出一种即可)。
⑶右图是MCFC燃料电池,它是以水煤气(CO、H2)为燃料,一定比例Li2CO3和Na2CO3低熔混合物为电解质。A为电池的________(填“正”或“负”)极,写出B极电极反应式:________________________。
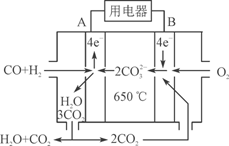
⑷工业上常用Na2CO3溶液吸收法处理氮的氧化物(以NO和NO2的混合物为例)。
已知:NO不能与Na2CO3溶液反应。
NO+NO2+Na2CO3=2NaNO2+CO2
2NO2+Na2CO3=NaNO2+NaNO3+CO2
①用足量的Na2CO3溶液完全吸收NO和NO2的混合物,每产生22.4 L(标准状况)CO2(全部逸出)时,吸收液质量就增加44 g,则混合气体中NO和NO2的体积比为
____________。
②用Na2CO3溶液吸收法处理氮的氧化物存在的缺点是____________。
SO3(g)+NO(g) △H=-Q kJ/mol(Q>0)可处理NO2、SO2等大气污染物,具有十分重要的意义。完成下列填空:










