-
下列大小关系正确的是( )
A. 晶格能:NaCl<NaBr B. 硬度:MgO>CaO C. 熔点:NaI>NaBr D. 熔沸点:CO2>NaCl
难度: 中等查看答案及解析
-
氢气是一种很有前途的能源物质。以水为原料大量制取氢气的最理想的途径是( )
A. 利用太阳能直接使水分解产生氢气
B. 用焦炭和水制取水煤气后分离出氢气
C. 用Fe跟HCl反应制取氢气
D. 由热电站提供电力,电解水产生氢气
难度: 中等查看答案及解析
-
下列说法中,正确的是 ( )
A.在化学反应过程中,发生物质变化的同时不一定发生能量变化
B.需要加热才能发生的化学反应,它可能是吸热反应也可能是放热反应
C.反应产物的总焓大于反应物的总焓时,反应吸热,ΔH<0
D.ΔH的大小与热化学方程式的计量系数无关
难度: 简单查看答案及解析
-
只有在化合物中才能存在的化学键是( )
A.离子键 B.共价键 C.π键 D.非极性键
难度: 简单查看答案及解析
-
对于反应4Fe(OH)2(s)+2H2O(l)+O2(g)=4Fe(OH)3(s) ΔH=-444.3kJ/mol,在常温常压下该反应能自发进行,对反应的方向起决定作用的是( )
A.温度 B.压强 C.焓变 D.熵变
难度: 简单查看答案及解析
-
具有如下电子层结构的原子,其相应元素一定属于同一主族的是( )
A.3p能级上有2个未成对电子的原子和4p能级上有2个未成对电子的原子
B.3p能级上只有1个空轨道的原子和4p能级上只有1个空轨道的原子
C.最外层电子排布为1s2的原子和最外层电子排布为2s22p6的原子
D.最外层电子排布为1s2的原子和最外层电子排布为2s2的原子
难度: 简单查看答案及解析
-
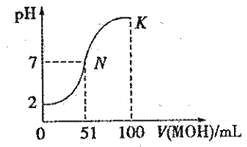
在电解质溶液的导电性装置(如图所示)中,若向某一电解质溶液中逐滴加入另一溶液,则灯泡由亮变暗至熄灭,后又逐渐变亮的是
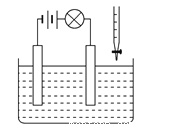
A.盐酸中逐滴加入食盐溶液
B.硫酸中逐滴加入NaOH溶液
C.硫酸中逐滴加入Ba(OH)2溶液
D.硫酸铜溶液中逐滴加入NaOH溶液
难度: 简单查看答案及解析
-
在容积不变的密闭容器中,可逆反应:4A(g)+5B(g)⇌3C(g)+6D(g)△H<0,达到化学平衡状态的标志是( )
A.气体密度不再发生变化
B.A的物质的量浓度不再改变
C.容器内总压强不再改变
D.单位时间内消耗4nmolA,同时消耗5nmolB
难度: 中等查看答案及解析
-
氨分解反应在容积为2 L的密闭容器内进行。已知起始时氨气的物质的量为4 mol,5 s末为2.4 mol,则用氨气表示该反应的速率为( )
A.0.32 mol·L-1·s-1 B.0.16 mol·L-1·s-1
C.1.6 mol·L-1·s-1 D.0.8 mol·L-1·s-1
难度: 简单查看答案及解析
-
下列变化过程中,原物质分子内共价键被破坏,同时有离子键形成的是
A.盐酸和NaOH溶液混合 B.氯化氢溶于水
C.溴化氢气体与氨气相遇反应 D.锌和稀硫酸反应
难度: 中等查看答案及解析
-
用酸性氢氧燃料电池为电源进行电解的实验装置示意图如下图所示。下列说法中,正确的是
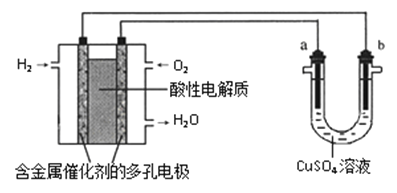
A.燃料电池工作时,正极反应为:O2 + 2H2O + 4e-= 4OH-
B.a极是铁,b极是铜时,b极逐渐溶解,a极上有铜析出
C.a极是粗铜,b极是纯铜时,a极逐渐溶解,b极上有铜析出
D.a、b两极均是石墨时,在相同条件下a极产生的气体与电池中消耗的H2体积相等
难度: 困难查看答案及解析
-
下列能级符号表示正确且最多容纳的电子数按照从少到多的顺序排列的是
A.1s、2p、3d B.1s、2s、3s
C.2s、2p、2d D.3p、3d、3f
难度: 简单查看答案及解析
-
关于化学反应中的能量变化,下列说法中不正确的是( )
A.燃烧反应都是放热反应
B.对于可逆反应:aA(g)+bB(g)
bC(g)+dD(g),如果正反应放热,逆反应一定吸热
C.氢气燃烧生成水是一个放热的化学反应,说明1 mol H2的能量高于1 mol H2O的能量
D.只有放热的氧化还原反应才可以设计为原电池
难度: 中等查看答案及解析
-
水的沸点为100℃,硫化氢的分子结构跟水相似,但它的沸点却很低,是-60.7℃,引起这种差异的主要原因是( )
A.范德华力 B.共价键 C.氢键 D.相对分子质量
难度: 简单查看答案及解析
-
以节能减排为基础的低碳经济是保持社会可持续发展的战略举措。下列做法违背发展低碳经济的是
A.发展氢能和太阳能
B.限制塑料制品的使用
C.提高原子利用率,发展绿色化学
D.尽量用纯液态有机物代替水作溶剂
难度: 简单查看答案及解析
-
关于金属腐蚀的叙述中,正确的是( )
A.金属被腐蚀的本质是M+nH2O=M(OH)n+
H2↑
B.马口铁(镀锡铁)镀层破损后被腐蚀时,首先是镀层被氧化
C.金属在一般情况下发生的电化学腐蚀主要是吸氧腐蚀
D.常温下,置于空气中的金属主要发生化学腐蚀
难度: 简单查看答案及解析
-
下列关于中和热的说法中正确的是( )
A.10 L 0.1 mol·L-1NaOH溶液与10 L 0.1 mol·L-1盐酸反应时的反应热是中和热
B.1 mol HCl气体通入1 L 0.01 mol·L-1NaOH溶液中反应时的反应热是中和热
C.1 mol CH3COOH与2 mol NaOH溶液反应时的反应热是中和热
D.只要强酸与强碱在稀溶液中反应生成1 mol水时的反应热就是中和热
难度: 简单查看答案及解析
-
实验室进行中和热测定的实验时除需要大烧杯(500 mL)、小烧杯(100 mL)外,所用的其他仪器和试剂均正确的一组是( )
A.0.50 mol·L-1盐酸,0.50 mol·L-1NaOH溶液,100 mL量筒1个
B.0.50 mol·L-1盐酸,0.55 mol·L-1NaOH溶液,100 mL量筒2个
C.0.50 mol·L-1盐酸,0.55 mol·L-1NaOH溶液,50 mL量筒1个
D.0.50 mol·L-1盐酸,0.55 mol·L-1NaOH溶液,50 mL量筒2个
难度: 简单查看答案及解析
-
下列轨道表示式能表示基态氮原子的核外电子排布的是( )
A.
 B.
B.
C.
 D.
D.
难度: 简单查看答案及解析
-
根据价层电子对互斥理论,判断下列分子或者离子的空间构型是平面三角形的是( )
A.CO2 B.H3O+ C.BF3 D.PO43﹣
难度: 中等查看答案及解析
-
在容积相同的A、B两个密闭容器中,分别充入2molSO2和1molO2,使它们在相同温度下发生反应:2SO2+O2
2SO3并达到平衡.在反应过程中,若A容器保持体积不变,B容器保持压强不变,当 A 中的 SO2 的转化率为25%时,则 B 容器中SO2的转化率应是
A.25% B.>25% C.<25% D.12.5%
难度: 中等查看答案及解析
-
关于离子晶体的下列说法正确的是( )
①离子晶体中的组成微粒是阴、阳离子 ②离子晶体中微粒间的作用是离子键 ③离子晶体中微粒间只存在异性电荷的互相吸引 ④离子晶体中只存在离子键
A.①② B.①③ C.②③ D.③④
难度: 中等查看答案及解析
-
某温度时,AgCl(s)
Ag+(aq)+Cl-(aq)在水中的沉淀溶解平衡曲线如图所示。
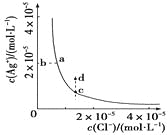
下列说法正确的是
A.加入AgNO3,可以使溶液由c点变到d点
B.加入少量水,平衡右移,Cl-浓度减小
C.d点没有AgCl沉淀生成
D.c点对应的Ksp等于a点对应的Ksp
难度: 中等查看答案及解析
-
某澄清、透明的浅黄色溶液中可能含有H+、NH4+、Fe3+、Ba2+、Al3+、SO42-、HCO3-、I-八种离子中的几种,在检验方案设计时初步分析其溶液中最多可含的离子(不包括OH-)有
A. 5 种 B. 6 种 C. 7 种 D. 8 种
难度: 中等查看答案及解析
-
对于反应2SO2(g)+O2(g)
2SO3(g),能增大正反应速率的措施是( )
A.通入大量O2 B.增大容器容积
C.移去部分SO3 D.降低体系温度
难度: 中等查看答案及解析
-
在20 mL 0.1 mol·L-1的醋酸溶液中,能使溶液的c(H+)增大,而且使醋酸的电离平衡向逆反应方向移动,可加入的试剂是( )
A.20 mL水 B.浓盐酸 C.冰醋酸 D.NaOH溶液
难度: 简单查看答案及解析
-
下列说法正确的是
A.放热反应的焓变小于零,熵变大于零
B.放热及熵增加的反应,一定能自发进行
C.放热反应的焓变大于零,熵变小于零
D.放热及熵减小的反应,一定能自发进行
难度: 简单查看答案及解析
-
下列说法中正确的是( )
A.含有非极性键的分子一定是非极性分子
B.非极性分子中一定含有非极性键
C.由极性键形成的双原子分子一定是极性分子
D.两个原子之间共用两对电子,形成的化学键一定有极性
难度: 简单查看答案及解析