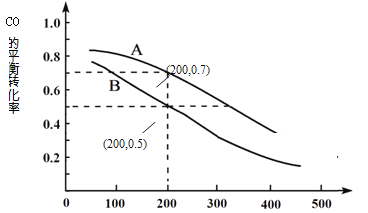
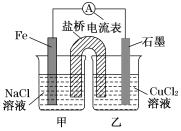
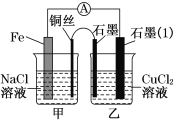
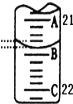
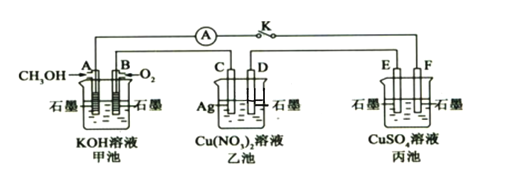
-
在室温下等体积的酸和碱的溶液,混合后pH 一定大于7的是 ( )
A. pH =3的硝酸跟pH =11的Ba(OH)2溶液
B. pH =3的盐酸跟pH =11的氨水溶液
C. pH =3的硫酸跟pH =11的KOH 溶液
D. pH =3的醋酸跟pH =11的Ba(OH)2溶液
难度: 困难查看答案及解析
-
下列有关金属腐蚀与防护的说法不正确的是
A.纯银器表面在空气中因化学腐蚀渐渐变暗
B.当镀锡铁制品的镀层破损时,镀层仍能对铁制品起保护作用
C.在海轮外壳连接锌块保护外壳不受腐蚀是采用了牺牲阳极的阴极保护法
D.可将地下输油钢管与外加直流电源的负极相连以保护它不受腐蚀
难度: 简单查看答案及解析
-
下列说法或表示方法正确的是( )
A.等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多
B.氢气的燃烧热为285.8 kJ·mol-1,则氢气燃烧的热化学方程式为2H2(g)+O2(g)=2H2O(l) ΔH=-285.8 kJ·mol-1
C.Ba(OH)2·8H2O(s)+2NH4Cl(s)= BaCl2(s)+2NH3(g)+10H2O(l) ΔH<0
D.已知中和热为57.3 kJ·mol-1,若将含0.5 mol H2SO4的浓溶液与含1 mol NaOH的 稀溶液混合,则放出的热量大于57.3 kJ
难度: 中等查看答案及解析
-
下列有关问题,与盐的水解有关的是( )
① NH4Cl 与 ZnCl2 溶液可作焊接金属中的除锈剂
②用 NaHCO3 与 Al2(SO4)3 两种溶液可作泡沫灭火剂
③草木灰与铵态氮肥不能混合施用
④实验室盛放碳酸钠溶液的试剂瓶不能用磨口玻璃塞
⑤加热蒸干 AlCl3 溶液得到 Al(OH)3 固体
A.①②③④⑤ B.②③④ C.①④⑤ D.①②③
难度: 中等查看答案及解析
-
以铁为阳极、铜为阴极,对足量的NaOH溶液进行电解,一段时间后得到2 mol Fe(OH)3沉淀,此时消耗水的物质的量共为( )
A.5mol B.4 mol C.3 moI D.2moI
难度: 中等查看答案及解析
-
把下列溶液加水稀释,溶液中每种离子的浓度都不会增加的是( )
A.CH3COOH溶液 B.NaCl溶液 C.NaOH溶液 D.FeCl3溶液
难度: 中等查看答案及解析
-
下列液体均处于25℃,有关叙述正确的是
A.某物质的溶液pH < 7,则该物质一定是酸或强酸弱碱盐
B.pH= 4.5的番茄汁中c(H+)是pH= 6.5的牛奶中c(H+)的100倍
C.AgCl在同浓度的CaCl2和NaCl溶液中的溶解度相同
D.pH= 5.6的CH3COOH与CH3COONa混合溶液中,c(Na+) > c(CH3COO-)
难度: 中等查看答案及解析
-
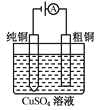
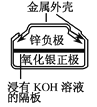
有关下列四个常用电化学装置的叙述中,正确的是( )
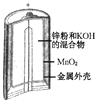

图Ⅰ 碱性锌锰电池
图Ⅱ铅硫酸蓄电池
图Ⅲ 电解精炼铜
图Ⅳ 银锌纽扣电池
A.图Ⅰ所示电池中,MnO2的作用是催化剂
B.图Ⅱ所示电池放电过程中,正极质量不断增大
C.图Ⅲ所示装置工作过程中,电解质溶液浓度始终不变
D.图Ⅳ所示电池中,放电时,负极附近溶液的pH不变
难度: 简单查看答案及解析
-
已知常温CH3COOH的电离平衡常数为K。该温度下向20 mL 0.1mol·L-1 CH3COOH溶液中逐滴加入0.1 mol·L-1 NaOH溶液,其pH变化曲线如图所示(忽略温度变化)。下列说法中错误的是( )
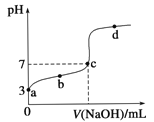
A.a点表示的溶液中c(CH3COO-)略小于10-3 mol·L-1
B.b点表示的溶液中c(CH3COO-)>c(Na+)
C.c点表示CH3COOH和NaOH恰好反应完全
D.b、d点表示的溶液中
均等于K
难度: 简单查看答案及解析
-
用如图装置电解K2SO4溶液,同时制备H2SO4溶液和KOH溶液,Ⅱ中装入K2SO4溶液,下列有关分析正确的是( )
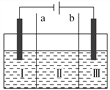
A. Ⅰ区生成H2SO4
B. a是阴离子交换膜
C. Ⅱ区的K+进入Ⅰ区
D. Ⅲ区溶液的pH会升高
难度: 中等查看答案及解析
-
已知:Ksp[Mg(OH)2]=1.8×10-11,Ksp[Cu(OH)2]=2.2×10-20。向浓度均为0.01 mol·L-1的Cu2+和Mg2+的混合溶液中逐滴加入NaOH溶液至过量,下列说法正确的是( )
A.较先出现的沉淀是Mg(OH)2
B.两种离子开始沉淀时,Cu2+所需溶液的pH较大
C.相同温度下Mg(OH)2的溶解度大于Cu(OH)2的溶解度
D.当两种沉淀共存时,溶液中Cu2+和Mg2+均不存在
难度: 中等查看答案及解析
-
某溶液只含有NaCl和H2SO4两种溶质,它们的物质的量之比为3:1。用石墨作电极电解该混合溶液时,根据电解产物,可明显分为几个阶段。下列叙述不正确的是
A.阴极自始至终只析出氢气 B.阳极先析出Cl2,后析出O2
C.电解的最后阶段为电解水 D.溶液pH不断增大,最后pH=7
难度: 中等查看答案及解析
-
草酸是二元中强酸,草酸氢钠溶液显酸性。常温下,向10 mL 0.01 mol•L-1 NaHC2O4溶液中滴加0.01 mol•L-1 NaOH溶液,随着NaOH溶液体积的增加,溶液中离子浓度关系正确的是( )
A.V(NaOH)=0时,c(H+)=1×10-2 mol•L-1
B.V(NaOH)<10 mL时,不可能存在c(Na+)=2c(C2O42-)+c(HC2O4-)
C.V(NaOH)=10 mL时,c(H+)=1×10-7 mol/L
D.V(NaOH)>10 mL时,c(Na+)>c(C2O42-)>c(HC2O4-)
难度: 简单查看答案及解析
-
已知NaHSO4在水中的电离方程式为NaHSO4=Na++H++SO42-。某温度下,向pH=6的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液pH为2。对于该溶液下列叙述不正确的是( )
A.该温度高于25℃
B.水电离出来的c(H+)=1×10-10mol/L
C.该温度下加入等体积pH为12的NaOH溶液可使反应后的溶液恰好呈中性
D.c(H+)=c(OH-)+c(SO42-)
难度: 简单查看答案及解析
-
铁—镍蓄电池充电放电时发生的反应为:
Fe+NiO2+2H2O
Fe(OH)2+Ni(OH)2
关于此蓄电池的下列说法中不正确的是
A.放电时Fe为负极
B.充电时阴极的电极反应式为Ni(OH)2-2e-===NiO2+2H+
C.放电时NiO2的反应为NiO2+2e-+2H2O===Ni(OH)2+2OH-
D.蓄电池的电极必须浸在碱性电解质溶液中
难度: 中等查看答案及解析
-
下列生产、生活等实际应用,不能用勒夏特列原理解释的是( )
A.溴水中有下列平衡Br2+H2O
HBr + HBrO,当加入AgNO3溶液后溶液颜色变浅
B.合成氨工业中使用铁触媒做催化剂
C.合成NH3反应,为提高NH3的产率,理论上应采取低温度的措施
D.对2HI(g)
H2(g)+I2(g),保持容器体积不变,通入氢气可使平衡体系颜色变浅
难度: 中等查看答案及解析
-
下列事实能说明醋酸是弱电解质的是
①醋酸与水能以任意比互溶;
②醋酸溶液能导电;
③醋酸稀溶液中存在醋酸分子;
④常温下,0.1 mol/L醋酸的pH比0.1 mol/L盐酸的pH大;
⑤醋酸能和碳酸钙反应放出CO2; ⑥0.1 mol/L醋酸钠溶液pH=8.9;
⑦大小相同的铁片与同物质的量浓度的盐酸和醋酸反应,醋酸产生H2速率慢
⑧pH=a的溶液的物质的量浓度等于pH=a+1的溶液的物质的量浓度的10倍
A.②⑥⑦⑧ B.③④⑥⑦ C.③④⑥⑧ D.①②
难度: 中等查看答案及解析
-
常温下,在20.00 mL 0.100 0 mol·L-1NH3·H2O溶液中逐滴滴加0.100 0 mol·L-1HCl溶液,溶液pH随滴入HCl溶液体积的变化曲线如图所示。下列说法正确的是( )
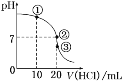
A.①溶液:c(Cl-)>c(NH4+)>c(OH-)>c(H+)
B.②溶液:c(NH4+)=c(Cl-)>c(OH-)=c(H+)
C.①、②、③三点所示的溶液中水的电离程度②>③>①
D.滴定过程中不可能出现:c(NH3·H2O)>c(NH4+)>c(OH-)>c(Cl-)>c(H+)
难度: 困难查看答案及解析