-
短周期主族元素X、Y、Z、R、W原子序数依次递增,且Y原子半径在这5种原子中最小,R单质是将太阳能转化为电能的常用材料,X和R原子最外层电子数相同;W2-的最外层为8电子结构,单质Z在空气中燃烧生成的化合物可与水发生氧化还原反应,下列说法正确的是
A. 简单离子半径W>Y>Z
B. 化合物ZY和RY4化学键类型相同
C. W、R最高价氧化物均能与水反应,且生成的酸的酸性W>R
D. W的最高价氧化物对应的水化物在与X单质反应时既显氧化性又显酸性
难度: 中等查看答案及解析
-
化学与人类社会的生产、生活有着密切联系。下列叙述中正确的是
A.切开的苹果和纸张久置在空气中变黄原理一致
B.铁制品和铜制品均能发生吸氧和析氢腐蚀
C.高温加热和“84”消毒液均可杀死禽流感病毒
D.根据我国最新垃圾分类标准,废旧干电池属于可回收垃圾
难度: 中等查看答案及解析
-
下列说法正确的是
A.实验室用加热氯化铵固体制取氨气
B.漂白粉属于混合物,液氯属于纯净物
C.醋酸、烧碱和过氧化钠分别属于酸、碱和碱性氧化物
D.煤的气化与液化均属于化学变化,煤的干馏属于物理变化
难度: 中等查看答案及解析
-
下列有关化学用语正确的是
A.羟基的电子式:
B.Cl-的结构示意图:
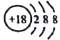
C.二氧化碳分子的比例模型:

D.葡萄糖的摩尔质量:180
难度: 中等查看答案及解析
-
三种气体X、Y、Z的相对分子质量关系为Mr(X)<Mr(Y)=0.5Mr(Z),下列说法正确的是
A.三种气体密度最小的是X
B.分子数目相等的三种气体,质量最大的是Y
C.若一定条件下,三种气体体积均为2.24 L,则它们的物质的量一定均为0.1 mol
D.20 ℃时,若2 mol Y与1 mol Z体积相等,则Y、Z气体所承受的压强比为2∶1
难度: 中等查看答案及解析
-
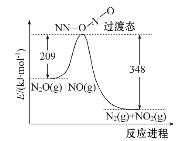
NH4N3(叠氮化铵)易发生爆炸反应:NH4N3
2N2↑+2H2↑,NA为阿伏加德罗常数的值,下列说法正确的是
A.1.8 g NH4+中含有的质子数为1mol
B.N2既是氧化产物,又是还原产物
C.6 g NH4N3晶体中含有的阴离子为0.1mol
D.爆炸反应中,当转移4mol电子时,产生89.6 L混合气体
难度: 中等查看答案及解析
-
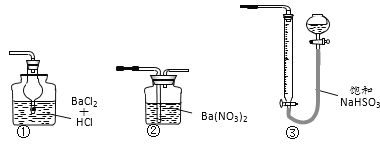
下列实验操作或检验正确的是
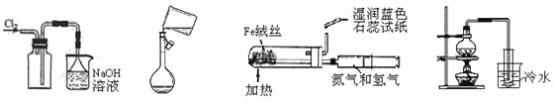
A.收集氯气 B.转移溶液 C.模拟工业制备并检验氨气 D.用海水制少量蒸馏水
难度: 中等查看答案及解析
-
常温下,下列各组离子在指定溶液中一定能大量共存的是
A.水电离产生的c(H+)=10-12 mol·L-1的溶液:K+、Na+、ClO-、I-
B.c(H+)/c(OH-)=1×10-12的溶液:K+、AlO2-、CO32-、Na+
C.硫化钠溶液:Cu2+、SO32-、Br-、H+
D.pH=13的溶液:AlO2-、Cl-、HCO3-、SO32-
难度: 中等查看答案及解析
-
南海是一个巨大的资源宝库,开发利用这些资源是科学研究的重要课题。下图为海水资源利用的部分过程,有关说法不正确的是
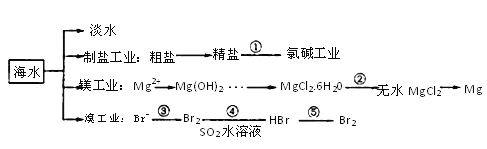
A.海水淡化的方法主要有蒸馏法、电渗析法、离子交换法
B.氯碱工业中采用阳离子交换膜可提高产品的纯度
C.由MgCl2·6H2O得到无水MgCl2的关键是要在干燥的氯化氢气流低温小火烘干
D.溴工业中③、④的目的是为了富集溴元素,溴元素在反应③、④、⑤中均被氧化
难度: 中等查看答案及解析
-
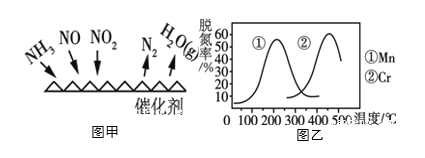
氮及其化合物的转化过程如图所示。下列分析合理的是
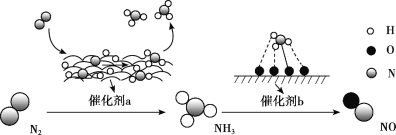
A. 催化剂a表面发生了极性共价键的断裂和形成
B. N2与H2反应生成NH3的原子利用率为100%
C. 在催化剂b表面形成氮氧键时,不涉及电子转移
D. 催化剂a、b能提高反应的平衡转化率
难度: 简单查看答案及解析
-
下列各组物质中,满足表中图示物质在一定条件下能一步转化的组合有
序号
X
Y
Z
W
①
Cu
CuSO4
Cu(OH)2
CuO
②
Na
NaOH
Na2CO3
NaCl
③
Al
AlCl3
Al(OH)3
Al2O3
④
Fe
FeCl3
FeCl2
Fe(OH)2
A. ②③ B. ①③④ C. ①④ D. ①②③
难度: 中等查看答案及解析
-
将装满气体X的试管倒置于装有液体Y的水槽中,充分振荡试管后,下列说法合理的是
气体X
液体Y
试管内现象
A
SO2
滴有品红的水溶液
无明显现象
B
NO2
水
充满无色溶液
C
NH3
滴有酚酞的水溶液
充满红色溶液
D
C2H4
酸性KMnO4溶液
无明显现象
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
下列离子方程式正确的是
A.实验室可以用浓盐酸和氯酸钾反应制氯气:K37ClO3+6HCl=3Cl2↑+3H2O+K37Cl
B.Na2S2O3溶液中加入稀硫酸:2S2O32-+4H+=3S↓+SO42-+2H2O
C.二氧化硫通入氯化钡溶液中:SO2+Ba2++H2O=BaSO3↓+2H+
D.向l0mL l mol·L-1 KAl(SO4)2的溶液中加入7.5mL 2 mol·L-1Ba(OH)2溶液:2Al3++3SO42-+6OH-+3Ba2+=2Al(OH)3↓+3BaSO4↓
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值,下列说法正确的是
A.常温常压下,22.4L Cl2与1mol FeI2反应时转移的电子数小于2NA
B.将1L 0.1 mol·L-1FeCl3溶液加入沸水中制得胶体,所含胶体粒子数目为0.1NA
C.120 g NaHSO4与KHSO3的固体混合物中阳离子数目大于NA
D.标准状况下,4.48L甲烷和乙烯的混合气体完全燃烧,产物中所含O-H键数目为0.4NA
难度: 中等查看答案及解析
-
水溶液X中可能溶有K+、Mg2+、Al3+、[Al(OH)4]-、SiO32-、SO32-、CO32-、SO42-中的若干种离子.某同学对该溶液进行了如下实验:
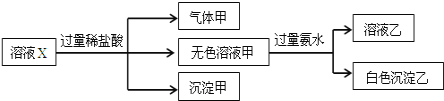
下列判断不正确的是( )
A.气体甲可能是混合物
B.沉淀甲是硅酸和硅酸镁的混合物
C.白色沉淀乙的主要成分是氢氧化铝
D.K+、[Al(OH)4]-和SiO32-一定存在于溶液X中
难度: 中等查看答案及解析
-
下列实验方案能达到实验目的的是
选项
实验目的
实验方案
A
鉴别NO2、溴蒸气
用湿润的淀粉碘化钾试纸放在集气瓶口,若试纸变蓝则该气体为溴蒸气
B
验证I-还原性强于Cl-
向NaI溶液中依次滴入少量新制氯水和苯,振荡、静置,上层溶液呈紫红色
C
检验Fe(NO3)2晶体是否已氧化变质
将Fe(NO3)2样品溶于稀硫酸后,滴加KSCN溶液,观察溶液是否变成红色
D
检验SO2的漂白性
将SO2气体通入酸性高锰酸钾溶液中,观察溶液是否褪色
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
C(s)+2H2(g)
CH4(g) ΔH。在1 L密闭容器中投入1mol碳,并充入2mol H2,测得相关数据如图所示。
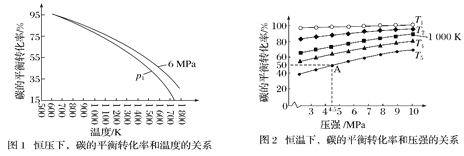
(已知:可用平衡分压代替平衡浓度算出平衡常数Kp,分压=总压×物质的量分数 )下列有关说法错误的
A.ΔH<0 B.p1<6MPa C.T1<1 000 K D.A点的平衡常数Kp=
难度: 困难查看答案及解析
-
下列有关离子检验的描述正确的是
①向久置的Na2SO3溶液中加入足量BaCl2溶液,出现白色沉淀;再加入足量稀盐酸,部分沉淀溶解,则部分Na2SO3被氧化
②将某溶液与稀盐酸反应产生的气体通入澄清石灰水,石灰水变浑浊,则该溶液中一定含有CO32-
③向某溶液中加稀硫酸和单质铜,溶液变蓝色,有无色、刺激性气味的气体生成,遇空气后变红棕色,说明原溶液含NO3-
④检验溶液中是否含有Fe2+:取少量待检验溶液,向其中加入少量新制氯水,再滴加KSCN溶液,观察实验现象
⑤向某溶液中加浓盐酸,将产生的气体通入品红溶液,品红溶液褪色,证明原溶液中含有SO32-
A.①②③ B.①③⑤ C.①③ D.②③④⑤
难度: 中等查看答案及解析
-
下图是用于航天飞行器中的一种全天候太阳能电化学电池在光照时的工作原理。下列说法正确的是
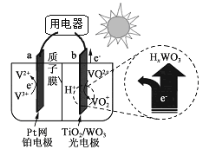
A.夜间无光照时,a电极流出电子
B.光照时,H+由a极室通过质子膜进入b极室
C.光照时,b极反应式是VO2++2OH--e-=VO2++H2O
D.该电池与硅太阳能电池供电原理相同
难度: 中等查看答案及解析
-
常温下,将等浓度的NaOH溶液分别滴加到等pH、等体积的HA、HB两种弱酸溶液中,溶液的pH与粒子浓度比值的对数关系如图所示。下列叙述错误的是( )

A. a点时,溶液中由水电离的c(OH-)约为1×10-10 mol·L-1
B. 电离平衡常数:Ka(HA)< Ka(HB)
C. b点时,c(B-)=c(HB)>c(Na+)>c(H+)>c(OH-)
D. 向HB溶液中滴加NaOH溶液至pH=7时:c(B-)> c(HB)
难度: 中等查看答案及解析