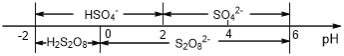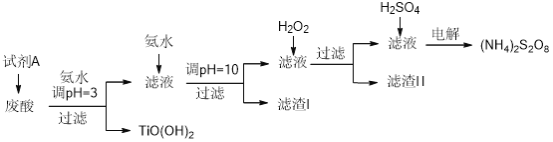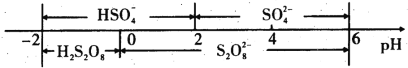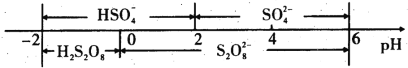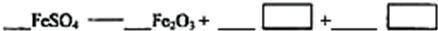-
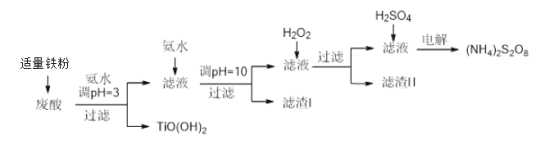
利用钛白粉厂废酸(主要含硫酸、Fe3+、Fe2+、TiO2+、Al3+)制备过二硫酸铵[(NH4)2S2O8],同时回收TiO(OH)2的简要流程如下:
已知:i.部分离子完全生成氢氧化物沉淀的pH:
| 金属离子 | TiO2+ | Fe3+ | Fe2+ | Al3+ |
| 开始沉淀的PH | 1.2 | 1.9 | 7.0 | 3.2 |
| 沉淀完全的pH | 2.8 | 3.1 | 9.4 | 4.7 |
ii.pH>7时,Fe2+部分生成Fe(II)氨络离子[Fe(NH3)2]2+。
请回答下列问题:
(1)加入适量铁的作用是________________________。
(2)生成TiO(OH)2的化学方程式是____________________。
(3)滤渣I、滤渣Ⅱ中均含有的物质的化学式是________
(4)加入H2O2的目的是氧化除掉Fe(II)氨络离子[Fe(NH3)2]2+,配平下列离子方程式:2[Fe(NH3)2]2+ +____________+4H2O +H2O2 =___________ + 4NH3·H2O 。
(5)常温下,电解液中含硫微粒主要存在形式与pH的关系如下图所示。
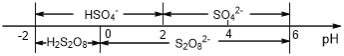
在阳极放电的离子主要为HSO4-,阳极区电解质溶液的pH范围为_________
(6)已知Ksp[Al(OH)3]=3.2×10-34 ,当pH=10 时,求溶液中c(Al3+)=___________
(7)25℃,pH=3的(NH4)2SO4溶液中,计算2c(SO42-)- c(NH4+) =___________(列式即可)
-
某厂废酸主要含硫酸、Fe3+、Fe2+、TiO2+、Al3+,利用该废液制备过二硫酸铵[(NH4)2S2O8]和TiO(OH)2的一种工艺流程如下:
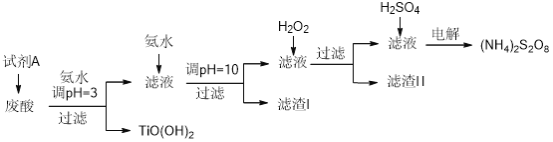
已知:i.
| 金属离子 | TiO2+ | Fe3+ | Fe2+ | Al3+ |
| 开始沉淀的pH | 1.2 | 1.9 | 7.0 | 3.2 |
| 沉淀完全的pH | 2.8 | 3.1 | 9.4 | 4.7 |
ii.pH>7时,Fe2+部分生成Fe(II)氨络离子[Fe(NH3)2]2+。
请回答下列问题:
(1)试剂A为__________,其作用是____________。
(2)取少量TiO(OH)2,用稀盐酸溶解,滴加少量KSCN溶液后无明显现象。再加入少量H2O2,出现微红色。焙烧TiO(OH)2获得的TiO2会发黄,发黄的杂质可能是__________(填化学式)。
(3)滤渣I的主要成分除Fe(OH)2、Al(OH)3外,还含有__________(填化学式)。
(4)加入H2O2的目的是氧化除掉Fe(II)氨络离子[Fe(NH3)2]2+,配平下列离子方程式:2[Fe(NH3)2]2++_____+4H2O+H2O2=______+4NH3·H2O
(5)过二硫酸铵中硫元素的化合价为__________。
(6)常温下,含硫微粒主要存在形式与 pH的关系如下图所示。

用惰性电极电解饱和NH4HSO4溶液制备过二硫酸铵时,在阳极放电的离子主要为HSO4-,则阳极区电解质溶液的pH范围为____<pH<____,其电极反应式为____________
-
某厂废酸主要含硫酸、Fe3+、Fe2+、TiO2+、Al3+ 。利用该废液制备过二硫酸铵[( NH4) 2S2O8]和TiO2的一种工艺流程如下:
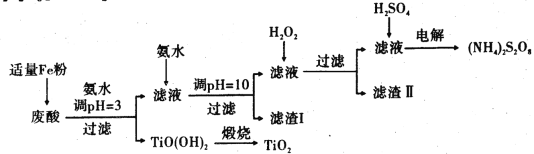
已知:i.TiOSO4在热水中易水解生成H2TiO3,相关离子形成氢氧化物沉淀的pH范围如 下表:
| 金属离子 | TiO2+ | Fe3+ | Fe2+ | Al3+ |
| 开始沉淀的pH | 1.2 | 1.9 | 7.0 | 3.2 |
| 沉淀完全的pH | 2.8 | 3.1 | 9.4 | 4.7 |
ii. pH>7 时,Fe2+部分生成 Fe( Ⅱ)氨络离Fe(NH3)2]2+o
请回答下列问题:
(1)加入适量Fe的作用是________________ .
(2)生成TiO(OH)2的化学方程式为_______________ 。
(3)滤渣I、滤渣II均含有的物质的化学式为_____________ .
(4)加入H2O2的目的是除掉Fe( Ⅱ)氨络离子[Fe(NH3)2]2+,此过程中氧化剂与还原剂的物质的量之比理论上等于________ (填数值)。
(5)常温下,含硫微粒主要存在形式与pH的关系如下图所示。
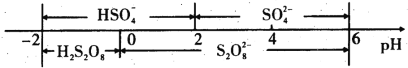
用Pt电极电解饱和NH4HSO4溶液制备过二硫酸铵时,为满足在阳极放电的离子主要为 HSO4-,应调节阳极区溶液的pH范围在______之间,其电极反应式为____________ 。
(6)科研人员常用硫酸铁铵[NH4Fe(SO4)2]滴定法测定TiO2的纯度,其步骤为: 用足量酸溶解wg 二氧化钛样品,用铝粉做还原剂,过滤、洗涤,将滤液定容为100 mL,取 25.00 mL,以NH4SCN作指示剂,用标准硫酸铁铵溶液滴定至终点,反应原理为: Ti3++Fe3+=Ti4++Fe2+。
①判断滴定终点的方法:________________________ 。
②滴定终点时消耗c mol/L-1 NH4Fe(SO4)2溶液VmL,则TiO2纯度为___________(写岀相关字母表示的代数式)。
-
某厂废酸主要含硫酸、Fe3+、Fe2+、TiO2+、Al3+ 。利用该废液制备过二硫酸铵[( NH4) 2S2O8]和TiO2的一种工艺流程如下:
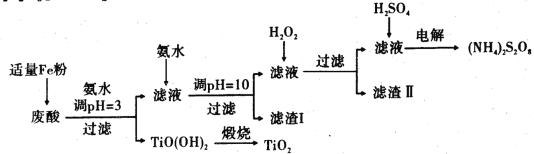
已知:i.TiOSO4在热水中易水解生成H2TiO3,相关离子形成氢氧化物沉淀的pH范围如 下表:
| 金属离子 | TiO2+ | Fe3+ | Fe2+ | Al3+ |
| 开始沉淀的pH | 1.2 | 1.9 | 7.0 | 3.2 |
| 沉淀完全的pH | 2.8 | 3.1 | 9.4 | 4.7 |
ii. pH>7 时,Fe2+部分生成 Fe( Ⅱ)氨络离Fe(NH3)2]2+o
请回答下列问题:
(1)加入适量Fe的作用是________________ .
(2)生成TiO(OH)2的化学方程式为_______________ 。
(3)滤渣I、滤渣II均含有的物质的化学式为_____________ .
(4)加入H2O2的目的是除掉Fe( Ⅱ)氨络离子[Fe(NH3)2]2+,此过程中氧化剂与还原剂的物质的量之比理论上等于________ (填数值)。
(5)常温下,含硫微粒主要存在形式与pH的关系如下图所示。
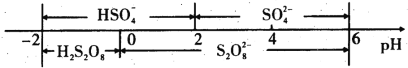
用Pt电极电解饱和NH4HSO4溶液制备过二硫酸铵时,为满足在阳极放电的离子主要为 HSO4-,应调节阳极区溶液的pH范围在______之间,其电极反应式为____________ 。
(6)科研人员常用硫酸铁铵[NH4Fe(SO4)2]滴定法测定TiO2的纯度,其步骤为: 用足量酸溶解wg 二氧化钛样品,用铝粉做还原剂,过滤、洗涤,将滤液定容为100 mL,取 25.00 mL,以NH4SCN作指示剂,用标准硫酸铁铵溶液滴定至终点,反应原理为: Ti3++Fe3+=Ti4++Fe2+。
①判断滴定终点的方法:________________________ 。
②滴定终点时消耗c mol/L-1 NH4Fe(SO4)2溶液VmL,则TiO2纯度为___________(写岀相关字母表示的代数式)。
-
以黄铁矿为原料制硫酸会产生大量的废渣,合理利用废渣可以减少环境污染,变废为宝。工业上利用废渣(含Fe2+、Fe3+的硫酸盐及少量CaO和MgO)制备高档颜料铁红(Fe2O3)和回收(NH4)2SO4,具体生产流程如下:
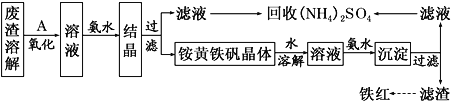
(1)在废渣溶解操作时,应选用________溶解(填字母)。
A.氨水 B.氢氧化钠溶液 C.盐酸 D.硫酸
(2) 为了提高废渣的浸取率,可采用的措施有哪些?_______________(至少写出两点)。
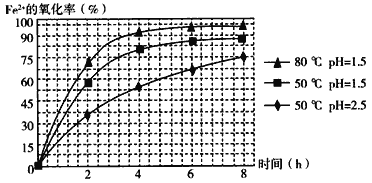
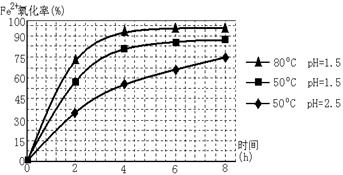
(3)物质A是一种氧化剂,工业上最好选用________(供选择使用的有:空气、Cl2、MnO2),其理由是_______________。氧化过程中发生反应的离子方程式为_________________。
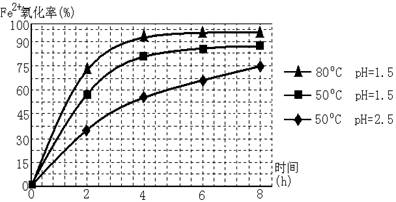
(4)根据如图有关数据,你认为工业上氧化操作时应控制的条件(从温度、pH和氧化时间三方面说明)是:______________________________________________________。
(5) 铵黄铁矾中可能混有的杂质有Fe(OH)3、________。
(6) 铵黄铁矾的化学式可表示为(NH4)xFey(SO4)z(OH)w,其化学式可通过下列实验测定:
① 称取一定质量的样品加入稀硝酸充分溶解,将所得溶液转移至容量瓶并配制成100.00 mL溶液A。
② 量取25.00 mL溶液A,加入盐酸酸化的BaCl2溶液至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体9.32 g。
③ 量取25.00 mL溶液A,加入足量NaOH溶液,加热,收集到标准状况下气体448mL,同时有红褐色沉淀生成。
④ 将步骤③所得沉淀过滤、洗涤、灼烧,最终得固体4.80 g。
通过计算,可确定铵黄铁矾的化学式为___________________________。(已知铵黄铁矾的摩尔质量为960g•mol-1,计算过程中不考虑固体损失和气体溶解。
-
以黄铁矿为原料制硫酸会产生大量的废渣,合理利用废渣可以减少环境污染,变废为宝。工业上利用废渣(含Fe2+、Fe3+的硫酸盐及少量CaO和MgO)制备高档颜料铁红(Fe2O3)和回收(NH4)2SO4,具体生产流程如下:
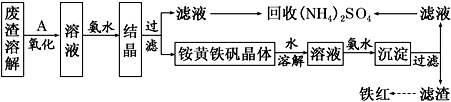
(1)在废渣溶解操作时,应选用________溶解(填字母)。
A.氨水 B.氢氧化钠溶液 C.盐酸 D.硫酸
(2) 为了提高废渣的浸取率,可采用的措施有哪些?_______________(至少写出两点)。
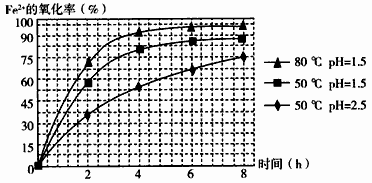
(3)物质A是一种氧化剂,工业上最好选用________(供选择使用的有:空气、Cl2、MnO2),其理由是_______________。氧化过程中发生反应的离子方程式为_________________。
(4)根据如图有关数据,你认为工业上氧化操作时应控制的条件(从温度、pH和氧化时间三方面说明)是:______________________________________________________。
(5) 铵黄铁矾中可能混有的杂质有Fe(OH)3、________。
(6) 铵黄铁矾的化学式可表示为(NH4)xFey(SO4)z(OH)w,其化学式可通过下列实验测定:
① 称取一定质量的样品加入稀硝酸充分溶解,将所得溶液转移至容量瓶并配制成100.00 mL溶液A。
② 量取25.00 mL溶液A,加入盐酸酸化的BaCl2溶液至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体9.32 g。
③ 量取25.00 mL溶液A,加入足量NaOH溶液,加热,收集到标准状况下气体448mL,同时有红褐色沉淀生成。
④ 将步骤③所得沉淀过滤、洗涤、灼烧,最终得固体4.80 g。
通过计算,可确定铵黄铁矾的化学式为___________________________。(已知铵黄铁矾的摩尔质量为960g•mol-1,计算过程中不考虑固体损失和气体溶解。
-
(12分)工业上利用硫酸渣(含Fe2+、Fe3+的硫酸盐及少量CaO和MgO)制备高档颜料铁红(Fe2O3)和回收(NH4)2SO4,具体生产流程如下:
| 注:铵黄铁矾化学式为(NH4)2Fe6(SO4)4(OH)12 | |
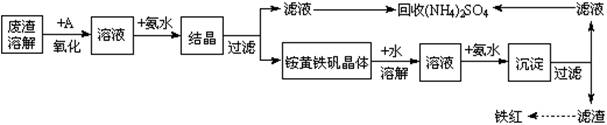
(1)在废渣溶解时需要使用酸,应选用__________,为了提高废渣的浸取率,可采用的措施有哪些?
_____________________________________________________________(至少写出两点)。
(2)物质A是一种氧化剂,工业上最好选用_____________(供选择使用的有:空气、Cl2、MnO2),其理由是________(至少写出两点)。
(3)“结晶”反应的化学方程式为__________________________________________________。
(4)上述生产流程中多处采用了过滤操作,实验室中完成相应的操作需要用到的玻璃仪器有烧杯及____________________________________________。
-
工业上利用硫酸渣(含Fe2-、Fe3-的硫酸盐及少量CaO和MgO)制备高档颜料铁红(Fe2O3)和回收(NH4)2SO4,具体生产流程如图:
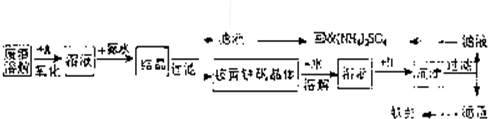
回答下列问题:
(1)在废渣溶解操作时,应选用______溶解(填编号).
A.硫酸 B.盐酸 C.氢氧化化钠 D.氨水
(2)物质A是一种氧化剂,工业上最好选用______(供选择使用的有:H2O2、空气、Cl2、MnO2等),其理由是______.
(3)根据下图有关数据,你认为工业上氧化操作时应采取的措施是______.
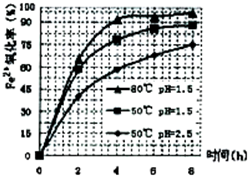
(4)往铵黄铁矾(化学式为:(NH4)2Fe6SO4)4(OH)12)溶液中加入溶液B至pH为5时产生沉淀,请写出产生沉淀的离子方程式:______.
(5)若对硫酸渣加强热也可粗制铁红,但产品纯度低而档次低,请写出硫酸渣中硫酸亚铁加强热制备铁红的化学方程式:
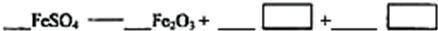
-
工业上利用硫酸渣(含Fe2+、Fe3+的硫酸盐及少量CaO和MgO)制备高档颜料铁红(Fe2O3 )和回收(NH4)2SO4,具体生产流程如下:
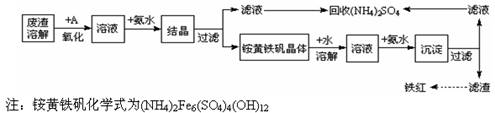
(1)在废渣溶解操作时,应选用__________溶解(填字母)。
A、氨水 B、氢氧化钠 C、盐酸 D、硫酸
(2)物质A是一种氧化剂,工业上最好选用(供选择使用的有:空气、Cl2、MnO2),其理由是。
(3)根据下图有关数据,你认为工业上氧化操作时应控制的条件是:。
(4)“结晶”反应的化学方程式为_____________________________________________。
(5)简述检验“滤液”中含有NH4+的实验方法:。
-
工业上利用硫酸渣(含Fe2+、Fe3+的硫酸盐及少量CaO和MgO)制备高档颜料铁红(Fe2O3 )和回收(NH4)2SO4,具体生产流程如下:
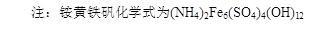
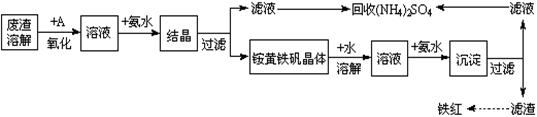
(1)在废渣溶解操作时,应选用__________溶解(填字母)。
A、氨水 B、氢氧化钠 C、盐酸 D、硫酸
(2)物质A是一种氧化剂,工业上最好选用(供选择使用的有:空气、Cl2、MnO2),其理由是。
(3)根据下图有关数据,你认为工业上氧化操作时应控制的条件是:
。
(4)“结晶”反应的化学方程式为
________。
(5)简述检验“滤液”中含有NH4+的实验方法:
。