-
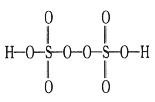
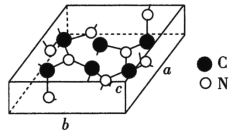
短周期主族元素X、Y、Z、M、W的原子序数依次增大,X元素的某种原子不含中子,X与M同主族,W的单质为黄色,W和Z同主族,5种元素最外层电子总数为19。下列说法正确的是
A. 元素周期表中,短周期主族元素共有18种
B. X、Y、Z、W均可以和M形成离子化合物
C. 以上5种元素形成的化合物中,从阳离子的分类角度来看,只能形成一类盐
D. 原子半径和离子半径均满足:Z<M
难度: 中等查看答案及解析
-
化学与科学技术、社会及生产生活密切相关。下列说法正确的是( )
A.石墨烯属于烯烃
B.可燃冰释放出气体的主要成分是甲烷
C.由废弃油脂生产的生物柴油的成分与矿物油的相同
D.我国书写材料经过甲骨、青铜、竹简、帛书及纸张的演变,它们都属于非金属材料
难度: 简单查看答案及解析
-
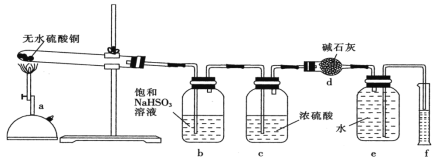
1,2-二溴乙烷(沸点为131℃),可溶于CCl4,某同学在实验室将乙烯通入溴的四氯化碳溶液中,在生成和纯化1,2-二溴乙烷的实验过程中,下列操作未涉及的是
A.
 B.
B.  C.
C.  D.
D. 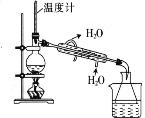
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值,下列说法正确的是
A.标准状况下,2.24LCl2通入NaOH溶液中反应转移的电子数为0.2NA
B.常温下,1LpH=11的NaOH溶液中由水电离出的H+的数目为10-11NA
C.273K、101kPa下,22.4L由NO和O2组成的混合气体中所含分子总数为NA
D.100g34%双氧水中含有H-O键的数目为2NA
难度: 困难查看答案及解析
-
硼化钒(VB2)-空气电池是目前储电能力最高的电池,示意图如图所示,该电池工作时的反应为4VB2+11O2=4B2O3+2V2O5。下列说法错误的是
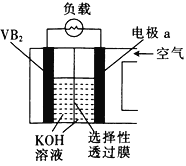
A.电极a的电势比VB2极的高
B.VB2极的电极反应式为2VB2-22e-+22OH-=2B2O3+V2O5+11H2O
C.放电时,OH-由VB2极向a电极移动
D.若采用稀盐酸作电解质溶液,则该电池发生的总反应改变
难度: 中等查看答案及解析
-
25℃时,改变醋酸溶液的pH[溶液中c(CH3COOˉ)与c(CH3COOH)之和始终为0.1mol·Lˉ1],溶液中H+、OHˉ、CH3COOˉ及CH3COOH浓度的对数值(lgc)与pH关系如图所示。
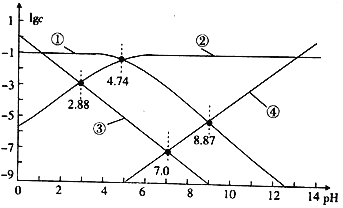
下列说法错误的是
A. lgK(CH3COOH)=-9.26
B. 图中①表示 CH3COOH浓度的对数值与pH的关系曲线
C. 0.1mol·Lˉ1CH3COOH溶液的pH约为2.88
D. 0.1mol·Lˉ1CH3 COONa溶液的pH约为8.87
难度: 困难查看答案及解析
-
下列实验操作得到的现象和结论均正确的是( )
选项
实验操作
现象
结论
A
在滴有酚酞的Na2CO3溶液中,加入BaCl2溶液
溶液褪色
BaCl2溶液显酸性
B
向25mL沸水中滴加5~6滴FeCl3饱和溶液,继续煮沸
生成红褐色沉淀
制得Fe(OH)3胶体
C
向H2S溶液中滴加CuSO4溶液
生成蓝色沉淀
H2S酸性比H2SO4强
D
向两支盛有KI3溶液的试管中,分别滴加淀粉溶液和AgNO3溶液
前者溶液变蓝,后者有黄色沉淀
KI3溶液中存在I2和I-
A.A B.B C.C D.D
难度: 中等查看答案及解析