-
下列事实中,能说明HCN是弱电解质的是
A.HCN易溶于水 B.NaCN是强电解质
C.NaCN溶液呈碱性 D.1 mol HCN与1 mol NaOH恰好完全反应
难度: 简单查看答案及解析
-
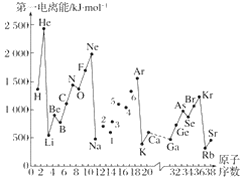
若n=3,以下能级符号错误的是( )
A.np B.nf C.nd D. ns
难度: 简单查看答案及解析
-
已知在25 ℃、101 kPa 下,11.4 g C8H18(辛烷)燃烧生成二氧化碳和液态水时放出 551.76 kJ 能量。表示上述反应的热化学方程式正确的是( )
A.C8H18(l)+
O2(g)=8CO2(g)+9H2O(g) ΔH=-551.76 kJ·mol-1
B.C8H18(l)+
O2(g)=8CO2(g)+9H2O(l) ΔH=-5517.6 kJ·mol-1
C.C8H18(l)+
O2(g)=8CO2(g)+9H2O(l) ΔH=5517.6 kJ·mol-1
D.C8H18(l)+
O2(g)=8CO2(g)+9H2O(l) ΔH=-551.76 kJ·mol-1
难度: 简单查看答案及解析
-
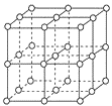
如图所示,食盐晶体由钠离子和氯离子构成。已知食盐的M=58.5g·mol-1,食盐的密度是2.2g·cm-3,阿伏加德罗常数为6.0×1023mol-1,在食盐晶体中两个距离最近的钠离子中心间的距离最接近下列哪个数据( )
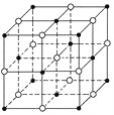
A.3.0×10-8cm B.3.5×10-8cm C.4.0×10-8cm D.5.0×10-8cm
难度: 中等查看答案及解析
-
一定温度下,向某容积恒定的密闭容器中充入1 mol N2、3 mol H2,经充分反应后达到如下平衡:N2(g)+3H2(g)
2NH3(g),下列有关说法中正确的是( )
A. 达平衡后再加入一定量的N2,体系内各物质含量不变
B. N2、H2、NH3的浓度一定相等
C. 反应没有达到平衡时,NH3会不断地分解,达到平衡时则不会再分解
D. 平衡时,N2、H2物质的量之比为1∶3
难度: 中等查看答案及解析
-
在做中和热测定实验时,应使用的仪器是( )
①量筒 ②托盘天平 ③烧杯 ④容量瓶 ⑤冷凝管 ⑥温度计 ⑦酒精灯
A.①③⑥ B.②③⑤ C.①②③⑥ D.①②⑥⑦
难度: 简单查看答案及解析
-
已知下列电子排布图所表示的是元素的原子,其中能量处于最低状态的是( )
A.
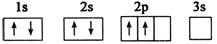
B.
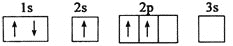
C.
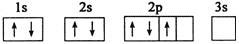
D.
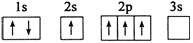
难度: 简单查看答案及解析
-
关于盐类水解反应的说法正确的是( )
A.溶液呈中性的盐一定是强酸与强碱生成的盐
B.含有弱酸根离子的盐的水溶液一定呈碱性
C.盐溶液的酸碱性主要决定于形成盐的酸、碱电离程度的相对大小
D.Na2S水解的离子方程式为:S2-+2H2O
H2S+2OH-
难度: 简单查看答案及解析
-
在各种各样的能源中,风能属于( )
A.化石能源 B.生物质能 C.二次能源 D.可再生能源
难度: 简单查看答案及解析
-
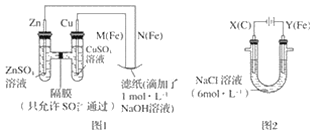
将H2S通入FeCl3溶液中,过滤后将反应液加入电解槽中电解(如下图所示),电解后的溶液还可以循环利用。该方法可用于处理石油炼制过程中产生的H2S废气。下列有关说法正确的是( )
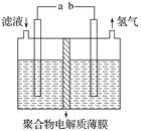
A.过滤得到的沉淀可能是FeS和S
B.若有0.20 mol电子转移,一定能得到2.24 L氢气
C.可以用Fe与外接电源的a极相连
D.与a极相连的电极反应为Fe2+-e-=Fe3+
难度: 困难查看答案及解析
-
Mg-AgCl电池是一种能被海水激活的一次性贮备电池,电池反应方程式为:
2AgCl+ Mg = Mg2++ 2Ag +2Cl-。有关该电池的说法正确的是
A.Mg为电池的正极
B.负极反应为AgCl+e-=Ag+Cl-
C.不能被KCl 溶液激活
D.可用于海上应急照明供电
难度: 中等查看答案及解析
-
对三硫化四磷分子的结构研究表明,该分子中没有不饱和键,且各原子的最外层均已达到了8个电子的结构。则一个三硫化四磷分子中含有的共价键个数是
A.7个 B.9个 C.19个 D.不能确定
难度: 中等查看答案及解析
-
已知铅蓄电池放电时的原电池反应:PbO2+Pb+2H2SO4===2PbSO4+2H2O。关于铅蓄电池的下列说法中正确的是( )
A. 放电时的正极反应式是Pb+SO42--2e-===PbSO4
B. 放电时电池的负极材料是铅板
C. 充电时,电池中硫酸的浓度不断变小
D. 充电时,铅板发生氧化反应
难度: 中等查看答案及解析
-
下列说法正确的是 ( )
A.增大压强,活化分子数增加,化学反应速率一定增大
B.升高温度,活化分子百分数增加,化学反应速率一定增大
C.活化分子间所发生的分子间的碰撞为有效碰撞
D.加入反应物,使活化分子百分数增加,化学反应速率增大
难度: 中等查看答案及解析
-
有关晶格能的叙述不正确的是( )
A.1mol气态金属阳离子离子和1mol气态阴离子离子结合生成1mol离子晶体时释放出的热能为离子晶体的晶格能
B.晶格能通常取正值
C.晶格能越大,形成的离子晶体越稳定
D.晶格能越大,物质的硬度反而越小
难度: 简单查看答案及解析
-
室温时,将浓度和体积分别为c1、V1的NaOH溶液和c2、V2的CH3COOH溶液相混合,下列关于该混合溶液的叙述错误的是( )
A.若pH>7,则一定是c1V1=c2V2
B.在任何情况下都是c(Na+)+c(H+)=c(CH3COO-)+c(OH-)
C.当pH=7时,若V1=V2,则一定是c2>c1
D.若V1=V2,c1=c2,则c(CH3COO-)+c(CH3COOH)=c(Na+)
难度: 中等查看答案及解析
-
水是最宝贵的资源之一。下列表述正确的是( )
A.向水中加入盐,对水的电离没有影响
B.在盐酸稀释过程中水的电离程度没有发生变化
C.水的电离程度很小,纯水中主要存在形态是水分子
D.向水中加入酸或碱,都可抑制水的电离,使水的离子积减小
难度: 简单查看答案及解析
-
在铁的吸氧腐蚀过程中,下列5种变化可能发生的是( )
①Fe由+2价转化成+3价 ②O2被还原 ③产生H2 ④Fe(OH)3失水形成Fe2O3·xH2O ⑤杂质C被氧化除去
A.①②④ B.③④ C.①②③④ D.①②③④⑤
难度: 简单查看答案及解析
-
用惰性电极电解AgNO3溶液,说法不正确的是( )
A.电解过程中阴极质量不断增加
B.电解过程中溶液的pH不断降低
C.此时向溶液中加入适量的Ag2O固体可使溶液恢复到电解前的状况
D.电解后两极产生的气体体积比为2∶1
难度: 中等查看答案及解析
-
下列变化不能用勒夏特列原理解释的是
A.合成氨是放热反应,采用在较高温度下进行反应
B.氯化镁溶液加热蒸干最终得不到氯化镁固体
C.工业生产硫酸的过程中使用过量的空气,以提高二氧化硫的转化率
D.实验室用排饱和食盐水的方法收集氯气
难度: 中等查看答案及解析
-
已知葡萄糖的燃烧热是 -2804 kJ/mol,当它氧化生成1 g 液态水时放出的热量是
A.26.0 kJ B.51.9 kJ C.155.8 kJ D.467.3 kJ
难度: 简单查看答案及解析
-
已知0.1 mol·L-1的醋酸溶液中存在电离平衡:CH3COOH
CH3COO-+H+,要使溶液中c(H+)/c(CH3COOH)值增大,可以采取的措施是( )
①加少量烧碱固体 ②升高温度 ③加少量冰醋酸 ④加水
A.①② B.②③ C.③④ D.②④
难度: 中等查看答案及解析
-
金刚石是典型的原子晶体,下列关于金刚石的说法中错误的是( )
A.晶体中不存在独立的“分子”
B.碳原子间以共价键相结合
C.是硬度最大的物质之一
D.化学性质稳定,即使在高温下也不会与氧气发生反应
难度: 简单查看答案及解析
-
已知图一表示的是可逆反应CO(g)+H2(g)
C(s)+H2O(g) ΔH>0的化学反应速率(v)与时间(t)的关系,图二表示的是可逆反应2NO2(g)
N2O4(g) ΔH<0的浓度(c)随时间(t)的变化情况。下列说法中正确的是( )
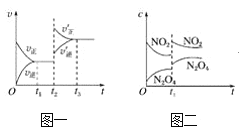
A. 若图一t2时改变的条件是增大压强,则反应的ΔH增大
B. 图一t2时改变的条件可能是升高了温度或增大了压强
C. 图二t1时改变的条件可能是升高了温度或增大了压强
D. 若图二t1时改变的条件是增大压强,则混合气体的平均相对分子质量将减小
难度: 中等查看答案及解析
-
番茄汁显酸性,在番茄上平行地插入铜片和锌片形成一个原电池,如图所示。以下叙述不正确的是( )
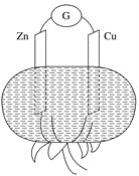
A.铜片为正极,锌片为负极
B.锌片上电极反应式:Zn -2e-===Zn2+
C.铜片上电极反应式:2H++2e-===H2↑
D.铜片上电极反应式:Cu2++2e-===Cu
难度: 简单查看答案及解析
-
如图是温度和压强对反应X+Y
2Z影响的示意图。图中横坐标表示温度,纵坐标表示平衡混合气体中Z的体积分数。下列叙述正确的是( )
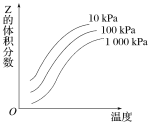
A.上述可逆反应的正反应为放热反应 B.X、Y、Z均为气态
C.X和Y中最多只有一种为气态,Z为气态 D.上述反应的逆反应的ΔH>0
难度: 中等查看答案及解析