-
化学与生活息息相关,下列说法正确的是
A.我国研制的重组新冠疫苗,需要冷藏保存
B.医用酒精灭杀新冠病毒是利用其氧化性
C.新冠病毒由 C、H、O三种元素组成
D.为增强“84”消毒液的消毒效果,可加入过量盐酸
难度: 简单查看答案及解析
-
下列有关化学用语表述正确的是
A.Cl-的结构示意图:
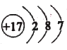
B.甲烷分子的比例模型:
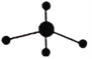
C.原子核内有 20 个中子的氯原子:
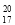 Cl
ClD.C
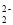 的电子式:
的电子式: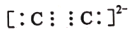
难度: 简单查看答案及解析
-
下列化学反应的能量变化符合如图所示关系的是

A.CaCO3
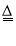 CaO + CO2↑
CaO + CO2↑B.2CH3CH2OH + O2
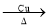 2CH3CHO+ 2H2O
2CH3CHO+ 2H2OC.2NH4Cl+ Ba(OH)2 = BaCl2+ 2NH3• H2O
D.2Na+2H2O =2NaOH + H2↑
难度: 困难查看答案及解析
-
用NA表示阿伏加德罗常数的值,下列说法正确的是
A.常温下,22.4L氮气的分子数大于 NA
B.56 g铁片投入足量浓 H2SO4 中生成NA个SO2分子
C.标准状况下,22.4 L CH3Cl 中含有的H 原子数目为3 NA
D.l mol 的羟基与1 mol 的氢氧根离子所含电子数均为9 NA
难度: 中等查看答案及解析
-
下列解释事实的方程式正确的是
A.用稀硫酸除去硫酸钠溶液中少量的硫代硫酸钠:Na2S2O3+2H++ SO2↑+S↓+2Na+ + H2O
B.氢氧化亚铁暴露于空气中会变色:4Fe(OH)2 + O2 + 2H2O= 4Fe(OH)3
C.将少量的 SO2气体通入NaClO溶液中:SO2 +H2O+ 2ClO- = SO
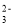 + 2HC1O
+ 2HC1OD.草酸使酸性KMnO4溶液褪色: 2MnO
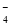 + 16H++ 5 C2O
+ 16H++ 5 C2O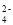 = 2Mn2+ + 10CO2↑+ 8H2O
= 2Mn2+ + 10CO2↑+ 8H2O难度: 困难查看答案及解析
-
T°C时,在某恒容的密闭容器中,发生如下反应:SO2(g) +2CO(g)
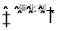 2CO2 (g)+ S(l)△H < 0;下列情况不能说明该反应达到平衡状态的是
2CO2 (g)+ S(l)△H < 0;下列情况不能说明该反应达到平衡状态的是A.容器内混合气体的密度不变
B.容器内压强不变
C.v(CO)生成= v(CO2)消耗
D.S的质量不再改变
难度: 中等查看答案及解析
-
下列说法正确的是
A.石油是混合物,其分馏产品汽油是纯净物
B.金属氧化物均为碱性氧化物
C.NH4Cl、HCl 中均含共价键, 二者均为共价化合物
D.核能、水能属于一次能源,水煤气、电能属于二次能源
难度: 简单查看答案及解析
-
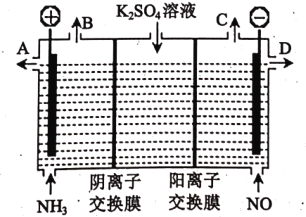
压缩天然气汽车以天然气代替汽车用油,具有价格低、污染少、安全等优点。未经处理的天然气含有H2S,直接使用会造成大气污染,T.F菌在酸性溶液中可实现天然气的催化脱硫,其原理如图所示。下列说法错误的是( )

A.Fe2(SO4)3可以视为该脱硫过程中的催化剂
B.该脱硫过程的总反应为:2H2S+O2=2S+2H2O
C.该脱硫过程不能在高温下进行
D.该脱硫过程是将H2S转化为FeSO4
难度: 简单查看答案及解析
-
在下列给定条件的溶液中, 一定能大量共存的离子组是
A.无色溶液中:K+、Cu2+ 、NO
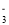 、Cl-
、Cl-B.常温下,
 =0.1的溶液中:Na+、K+、AlO2-、CO
=0.1的溶液中:Na+、K+、AlO2-、CO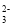
C.0. l mol•L-1的FeCl2溶液中 :K+、SO
 、Mg2+、MnO
、Mg2+、MnO
D.Na2S溶液中:SO
 、H+、Cl-、Cu2+
、H+、Cl-、Cu2+难度: 中等查看答案及解析
-
下列说法正确的是
A.乙二醇和丙三醇是同系物
B.丙烯和苯分子中的所有原子都在同一平面内
C.欲除去乙烷中混有的乙烯可选用酸性 KMnO4溶液洗气
D.将乙烯通入溴的四氯化碳溶液,溶液最终变为无色透明且未见分层,则说明生成的1, 2-二溴乙烷无色, 并可溶于四氯化碳
难度: 简单查看答案及解析
-
下列说法正确的是
A.除去FeSO4 溶液中的 Fe3+, 可向溶液中加入铜粉, 通过反应 Cu + 2Fe3+ = Cu2+ + 2Fe2+除去 Fe3+
B.常温下,pH为5的 NH4Cl 溶液和pH为5的稀盐酸中,水的电离程度相同
C.由于存在水的电离,0.1 mol•L-1 的 H2C2O4溶液中, c(H+)/c(C2O
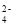 )略大于2
)略大于2D.向氨水中滴加等浓度的盐酸溶液,滴加过程中,c(NH
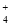 )先增大后减小
)先增大后减小难度: 中等查看答案及解析
-
短周期主族元素 X、Y、Z、M、R 的原子半径和最外层电子数之间的关系如图所示。
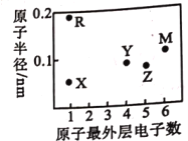
下列说法正确的是
A.化合物 RX 中含有共价键
B.Y、Z、M 的氧化物均能溶于水
C.化合物R2M 是弱电解质,其水溶液显碱性
D.试管壁上残留的M 单质可以用热的NaOH溶液除去
难度: 困难查看答案及解析
-
下列有关实验操作的叙述正确的是
A.洗净的锥形瓶和容量瓶可以放进烘箱中烘干
B.用向上排空气法收集铜粉和稀硝酸反应产生的NO
C.鉴别 NaBr 溶液和 NaI 溶液, 可分别加新制氯水后,用 CCl4萃取
D.用标准盐酸溶液滴定 NaHCO3 溶液来测定其浓度, 选择酚酞为指示剂
难度: 中等查看答案及解析
-
当溶液中离子浓度小于1.0×10-5 mol•L-1 时,可视为该离子已完全除去,通过调节溶液pH的方法可以除去溶液中的某些杂质离子。常温下,某0.1 mol•L-1 的NiSO4溶液中含有杂质Al3+和 Fe3+,欲将这两种杂质完全除去, 需调节溶液pH 的范围可以是(不考虑溶液体积变化,已知:常温时,氢氧化镍Ksp = 1×10-16、 氢氧化铁Ksp =1×10-38、氢氧化铝Ksp = 1×10 -33)
A.2~3 B.3~4
C.5 ~6 D.6~8
难度: 中等查看答案及解析
-
关于如图所示的有机物,下列说法正确的是
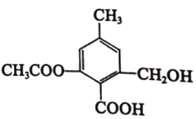
A.分子式为 C10H14O6,属于苯的同系物
B.含有的官能团为羟基、羧基和酯基
C.不能发生取代反应和加成反应,但能发生加聚反应
D.该分子不能使酸性高锰酸钾溶液褪色,也不能使溴水褪色
难度: 中等查看答案及解析
-
某同学在实验报告中有以下实验数据,其中数据合理的是
A.用500 mL容量瓶配制250 mL 0.2 mol•L-1 NaOH 溶液
B.滴定管的“0”刻度线在上端,量筒的 “0”刻度线在下端
C.用广泛pH 试纸测得某醋酸溶液的pH为2.46
D.用酸式滴定管量取23.10 mL溴水
难度: 中等查看答案及解析
-
下列实验的操作、现象和结论均正确的是
实验操作
实验现象
实验结论,
A
向FeCl3和 KSCN的混合溶液中滴加NaOH溶液
混合溶液颜色逐渐变浅,有红褐色沉淀产生
Fe3+与SCN-生成Fe(SCN)3是可逆反应
B
将密封有红棕色NO2气体的圆底烧瓶浸入冰水中
气体颜色变浅
反应2NO2
 N2O4△H>0
N2O4△H>0C
分别向0.1 mol·L- 1的醋酸和饱和硼酸溶液中滴加等浓度的Na2CO3溶液
醋酸溶液中有气泡产生,硼酸溶液中无气泡
酸性:硼酸>醋酸>碳酸
D
将0.1 mol·L-1AgNO3溶液和0.05mol·L-1NaCl溶液等体积混合,再向混合液中滴入0.05 mol·L-1NaI溶液
先产生白色沉淀,后产生黄色沉淀
Ksp(AgI)<Ksp(AgCl)
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
在酸性介质中,H2O2能使 KMnO4溶液褪色,离子反应(未配平)为:MnO
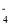 + H+ + H2O2→Mn2++ O2 + H2O,下列说法错误的是
+ H+ + H2O2→Mn2++ O2 + H2O,下列说法错误的是A.氧化性比较:MnO
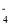 > O2
> O2B.该反应中酸性介质可以为盐酸
C.氧化剂与还原剂的物质的量之比为2∶5
D.若有0.1 mol氧化产物生成, 则转移电子0.2 mol
难度: 中等查看答案及解析
-
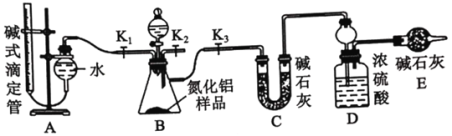
某课外活动小组设计了如图所示的装置研究金属的腐蚀和电化学防护。下列相关说法错误的是
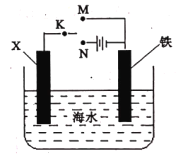
A.若X是碳棒,将开关K置于M处,铁棒的腐蚀加快
B.若X是铜棒,将开关K置于N处,铁棒难以被腐蚀
C.若X是碳棒,将开关K 置于N处,铁棒的腐蚀加快
D.若X是锌棒,将开关K置于M处,铁棒上发生的反应为:O2+ 2 H2O + 4e- = 4OH-
难度: 中等查看答案及解析
-
常温下,向10 mL 0.2mol•L-1 的MOH中逐滴加入0.2 mol•L-1的CH3COOH溶液,溶液的导电能力如图1所示,溶液的pH 变化如图2所示(已知:常温时,NH3∙H2O和CH3COOH的电离常数均为1.8×10-5), 下列说法正确的是
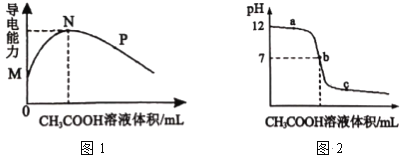
A.图l中N点时,加入CH3COOH溶液的体积为l 0 mL
B.MOH是一种弱碱,相同条件下其碱性弱于 NH3•H2O 的碱性
C.图2中b点时,加入CH3COOH溶液的体积为l 0 mL
D.若c点对应醋酸的体积是15 mL,则此时溶液中:c(CH3COOH) + c(CH3COO-) < 0.1 mol•L-1
难度: 困难查看答案及解析

 表示的分子式为_________,名称是____________。
表示的分子式为_________,名称是____________。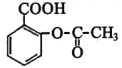 含有的官能团的名称为_____________,写出该物质在酸性环境下水解产物的结构简式__________、__________。
含有的官能团的名称为_____________,写出该物质在酸性环境下水解产物的结构简式__________、__________。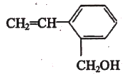 最多______个原子共平面,写出该物质发生加聚反应的化学方程式_________。
最多______个原子共平面,写出该物质发生加聚反应的化学方程式_________。 5N2 ( g) + 6H2O(g) △H = -1804 kJ•mol-1
5N2 ( g) + 6H2O(g) △H = -1804 kJ•mol-1