-
实验是化学的灵魂,下列关于实验现象的叙述正确的是
A. 将CO2通入BaCl2溶液中至饱和,无沉淀产生:再通入SO2,产生沉淀
B. 在稀硫酸中加入铜粉,铜粉不溶解:再加入Cu(NO3)2固体,铜粉仍不溶解
C. 向AlCl3溶液中逐滴加入氨水至过量,先产生白色沉淀,后又逐渐溶解
D. 纯铁与稀硫酸反应产生氢气速率较慢,如滴入几滴硫酸铜溶液,速率加快
难度: 中等查看答案及解析
-
下列属于酸的是
A.NH4Cl B.KHSO4 C.HOCl D.CO2
难度: 简单查看答案及解析
-
由一种阳离子与两种酸根阴离子组成的盐称为混盐,CaOCl2是一种常见的混盐。下列说法不正确的是( )
A.CaOCl2有较强的氧化性
B.CaOCl2水溶液呈碱性
C.由氯气为原料,每生成1molCaOCl2,转移的电子为2mol
D.CaOCl2的溶液中加入足量浓硫酸,可有黄绿色的气体产生
难度: 中等查看答案及解析
-
下列说法正确的是( )
A.葡萄糖在一定条件下可以水解生成乙醇和二氧化碳
B.进行淀粉水解实验时,为检验水解产物和水解是否完全,加液顺序通常如下:淀粉溶液→稀硫酸→NaOH溶液→碘水→新制Cu(OH)2悬浊液
C.制备乙酸乙酯时,向乙醇中缓慢加入浓硫酸和冰醋酸,加热,将导气管插入饱和Na2CO3溶液中以便于除去乙醇和乙酸
D.等质量的甲醛、乙酸、葡萄糖充分燃烧,消耗氧气的质量相等
难度: 中等查看答案及解析
-
下列有关石油和煤的利用叙述不正确的是( )
A.煤的干馏就是将煤隔绝空气在高温条件下使之分解,得到焦炭、煤焦油等物质的过程
B.煤的液化就是将煤转化成甲醇、乙醇等其液态物质的过程
C.煤的气化就是将煤在高温条件下由固态转化为气态的物理变化过程
D.石油通过催化裂化或裂解,可以获得碳原子数较少的轻质油
难度: 简单查看答案及解析
-
用下列实验方案及所选玻璃仪器(非玻璃仪器任选〉就能实现相应实验目的的是
实验目的
实验方案
所选玻璃仪器
A
除去KNO3中少量NaCl
将混合物制成热的饱和溶液,冷却
结晶,过滤
酒精灯、烧杯、玻璃棒
B
海带提碘
将海带剪碎,加蒸馏水浸泡,取滤
液加稀硫酸和H2O2
试管、胶头滴管、
烧杯、漏斗
C
测定饱和NaClO溶液、CH3COONa溶液的pH值
分别蘸取两种溶液滴在pH试纸上,
颜色稳定后与标准比色卡对照
玻璃捧、玻璃片
D
配制480mL0.5mol/LCuSO4溶液
将称量好的 62.5 g CuSO4 • 5H2O 溶解、冷却、转移、洗涤、定容、摇匀
烧杯、玻璃棒、量筒、一定规格的容
量瓶、胶头滴管
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下列影响化学反应速率的因素中,属于内在因素的是
A.物质的性质 B.浓度 C.温度 D.催化剂
难度: 简单查看答案及解析
-
十八大以来,我国科学技术迅猛发展。下列设备工作时,将化学能转化为电能的是
A
B
C
D




太阳能集热
燃气燃烧
风力发电
手机电池工作
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
下列有关物质用途的说法中,不正确的是
A.75%的乙醇溶液作医用消毒剂 B.Fe3O4用作红色油漆和涂料
C.ClO2可用作自来水消毒剂 D.Na2O2用作呼吸面具等的供氧剂
难度: 简单查看答案及解析
-
自然界的氮循环如图所示。下列说法中,不正确的是

A.植物的根瘤菌可起固氮作用
B.雷电作用下实现了人工固氮
C.在氮循环过程中涉及了多个氧化还原反应
D.含氮无机物与含氮有机化合物可相互转化
难度: 简单查看答案及解析
-
反应NH4Cl+NaNO2
 NaCl+N2↑+2H2O放热且产生气体,可用于冬天石油开采。下列表示反应中相关微粒的化学用语正确的是
NaCl+N2↑+2H2O放热且产生气体,可用于冬天石油开采。下列表示反应中相关微粒的化学用语正确的是A.中子数为18的氯原子:
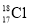
B.N2的结构式:N=N
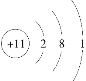
C.Na+的结构示意图:
D.H2O的电子式:
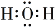
难度: 简单查看答案及解析
-
化学与生产、生活密切相关。下列说法错误的是
A.CO2、SO2 和 NO2 都会导致酸雨的形成,同时 NO2 还能引起光化学烟雾
B.绿色化学要求从源头上消除或减少生产活动对环境的污染
C.通常所说的三大合成材料是指塑料、合成纤维和合成橡胶
D.氮化硅可用于制作耐高温轴承、计算机芯片用到高纯硅、水晶镜片用到二氧化硅
难度: 简单查看答案及解析
-
下列说法正确的是
A.SiO2制成的玻璃纤维,由于导电能力强而被用于制造通讯光缆
B.水分子中O-H键的键能很大,因此水的沸点较高
C.Na2O2中 既含有离子键又含有共价键,但Na2O2属于离子化合物
D.1 mol NH3中含有共用电子对数为4NA (NA为阿伏加德罗常数的值)
难度: 简单查看答案及解析
-
下列实验装置或操作与实验目的不相符的是
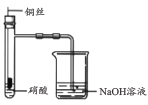
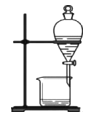


A. 证明铜与硝酸的反应
B. 分离乙醇和乙酸的混合液
C. 证明氨气易溶于水且水溶液呈碱性
D. 配制100 mL0.100 mol/LNaCl溶液
A.A B.B C.C D.D
难度: 简单查看答案及解析
-
已知:BF3和水反应生成氟硼酸(HBF4)和硼酸(H3BO3),一定条件下BF3与一定量水可形成
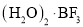 晶体Q(
晶体Q( )。下列有关说法,正确的是
)。下列有关说法,正确的是A.BF3和水反应生成氟硼酸和硼酸是氧化还原反应
B.BF3分子中,每个原子的最外层都具有8电子稳定结构
C.晶体Q中存在离子键、共价键、范德华力和氢键
D.H3BO3在水中只发生反应:
 ,可知硼酸是一元酸
,可知硼酸是一元酸难度: 中等查看答案及解析
-
我国科研人员提出了由CO2和CH4转化为高附加值产品CH3COOH的催化反应历程。该历程示意图如图:

下列说法不正确的是( )
A.①→②放出能量
B.①→②中形成碳碳键
C.①→②中碳氢键发生断裂
D.由②得到乙酸的过程中,形成了氧氢键
难度: 简单查看答案及解析
-
关于下列各图的叙述中,不正确的是
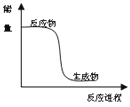



①
②
③
④
A.图①所示曲线,表示该反应是放热反应
B.图②所示柱形图,纵坐标表示第二周期元素最高正价随原子序数的变化
C.用装置③可进行钾在空气中燃烧实验,验证钾比钠活泼
D.装置④为原电池,总反应是:Fe+2Fe3+=3Fe2+
难度: 中等查看答案及解析
-
碳固体氧化物电池是一种高效、环境友好的燃料电池。电池工作时,物质的转化原理如下图所示。下列说法正确的是

A.多孔电极a上,氧气发生氧化反应
B.多孔电极b的反应:CO-2e-+O2-=CO2
C.整个装置的总反应:CO2+C=2CO
D.该电池能将碳燃料产生的能量100%转化为电能
难度: 中等查看答案及解析
-
已知2HI(g)⇌H2(g) +I2(g), 443℃时IL密闭容器中充入1 mol HI,体系中c(HI)与反应时间t的关系如图所示。下列说法正确的是

A.0~20 min内,v(H2) = 0.0045mol·L-1·min-1 B.升高温度,HI会完全分解
C.40 min时,c(H2) = 0.075mol·L-1 D.120 min反应达到最大限度,此时HI的转化率为78%
难度: 中等查看答案及解析
-
固体粉末
 中可能含有
中可能含有 、
、 、
、 、
、 、
、 和
和 中的若干种。为确定该固体粉末的成分,某同学依次进行了以下实验:
中的若干种。为确定该固体粉末的成分,某同学依次进行了以下实验:①将
 加入足量水中,得到不溶物
加入足量水中,得到不溶物 和溶液
和溶液 ;
;②取少量
 加入足量浓盐酸,加热,产生黄绿色气体,并有少量红色不溶物;
加入足量浓盐酸,加热,产生黄绿色气体,并有少量红色不溶物;③用玻璃棒蘸取溶液
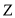 滴于
滴于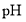 试纸上,试纸呈蓝色;
试纸上,试纸呈蓝色;④向溶液
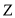 中滴加
中滴加 溶液,生成白色沉淀。
溶液,生成白色沉淀。通过以上实验现象,下列结论正确的是( )
A.
 中一定不存在
中一定不存在
B.不溶物
 中一定含有
中一定含有 和
和 ,而Fe与
,而Fe与 中至少含有一种
中至少含有一种C.
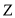 溶液中一定含有
溶液中一定含有
D.若向④生成的白色沉淀中滴加过量盐酸,沉淀不完全溶解,则粉末
 中含有
中含有
难度: 中等查看答案及解析
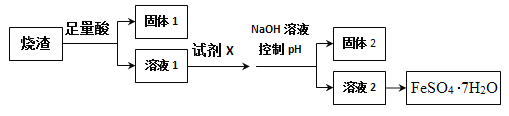



 替代,请将Na2CO3溶液吸收Br2的反应化学方程式补充完整:____Br2+_____Na2CO3=_____NaBrO3+___________+________,________
替代,请将Na2CO3溶液吸收Br2的反应化学方程式补充完整:____Br2+_____Na2CO3=_____NaBrO3+___________+________,________