-
海水是巨大的资源宝库。下图是人类从海水资源获取某些重要化工原料的流程示意图。
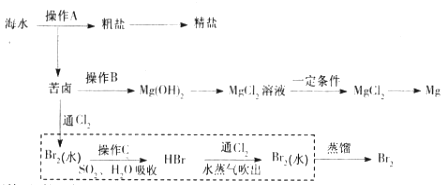
回答下列问题:
(1)操作A是_______________(填实验基本操作名称)。要知道海水晒盐的过程中溶液里食盐含量在逐渐提高的简易方法是__________________。
a.分析氯化钠含量 b.测定溶液密度 c.观察是否有沉淀析出
(2)操作B需加入下列试剂中的一种,最合适的是_____________。
a.氢氧化钠溶液 b.澄清石灰水 c.石灰乳d.碳酸钠溶液
(3)上图中虚线框内流程的主要作用是_____________。写出溴水中通入SO2时反应的离子方程式____________
(4)上图中虚线框内流程也可用 Br2与Na2CO3反应的化学方程式补充完整:
Br2与Na2CO3反应的化学方程式补充完整:
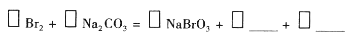 ___________
___________
(5)已知苦卤的主要成分如下:

理论上,1 L苦卤最多可得到Mg(OH)2的质量为________g。
-
海水是巨大的资源宝库。下图是实验室模拟工业从海水资源获取某些重要化工原料的流程示意图。

回答下列问题:
(1)要知道海水晒盐的过程中溶液里食盐含量在逐渐提高的简易方法是___________。
A.分析氯化钠含量B.测定溶液密度C.观察是否有沉淀析出
(2)由于溴离子在海水中浓度很低(0.067g/L),要进行溴元素的浓缩、富集。实验室若要直接浓缩海水时,下面的仪器肯定不需要的是(填编号)__________
A.玻璃棒B.三脚架C.坩埚D.蒸发皿E.酒精灯
(3)写出操作C反应的离子方程式____________。
(4)上图中虚线框内流程也可用 替代,请将Na2CO3溶液吸收Br2的反应化学方程式补充完整:____Br2+_____Na2CO3=_____NaBrO3+___________+________,________
替代,请将Na2CO3溶液吸收Br2的反应化学方程式补充完整:____Br2+_____Na2CO3=_____NaBrO3+___________+________,________
(5)海水中的碘有浓度很小,通过富集的海生植物中,可从海带提碘,流程如下:

a.第②步为了加快溶解速率并使充分进入溶液中,可以采取的措施是:______________________、______________________(写出两条)。
b.写出第④步发生反应的离子方式_____________________________。
(6)MgCl2可电解制Mg,MgO则是重要的耐火材料。在550℃时,MgCl2·6H2O会分解生成MgO、MgCl2、HCl和H2O,若不补充其它原料,使一定量的MgCl2·6H2O全部生成amolMgO、bmolMgCl2和36.5%的盐酸,则a∶b为______________(取整数值)。
-
海水是人类资源的宝库,“海水晒盐”是获取食盐的重要来源。食盐既是一种生活必需品,也是一种重要的工业原料。以食盐为原料可以得到多种产品。工业上主要通过电解饱和氯化钠溶液的方法获得氢氧化钠。
(1)阳极反应式为 ,检验该电极反应产物的方法是: 。
(2)当阴极和阳极上共收集到气体22.4 L时(标准状况下,假设产生的气体完全被收集),则电路中通过电子的个数为 。
(3)电解氯化钠稀溶液可以制备“84”消毒液,若通电时产生的氯气被溶液完全吸收,且最终所得消毒液仅含一种溶质,请写出相应的化学方程式: (用一个方程式表示)。
-
海水是巨大的资源宝库。下图表示以海水为基本原料的相关工业,其中不符合实际情况的是
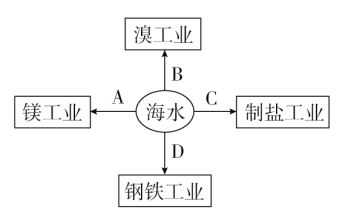
A. A B. B C. C D. D
-
南海是一个巨大的资源宝库,开发利用这些资源是科学研究的重要课题。下图为海水资源利用的部分过程,有关说法正确的是( )
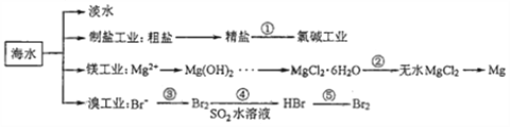
A. 海水淡化的方法主要有蒸馏法、电渗析法、冰冻法
B. 氯碱工业中采用阴离子交换膜可提高产品的纯度
C. 由MgCl2·6H2O得到无水MgCl2的关键是要低温小火烘干
D. 溴工业中③、④的目的是为了富集溴元素,溴元素在反应③、⑤中均被氧化,在反应④中被还原
-
海洋是一个巨大的资源宝库,海水中有大量可以利用的化学资源,例如氯化镁、氯化钠、溴化钠等。可用于制食盐、Mg、Br2、H2、Cl2、NaOH等化工原料。回答下列问题:
(1)Mg元素位于周期表第______周期_______族。
(2)写出NaOH的电子式_______________。
(3)写出电解饱和食盐水的离子方程式:____________。
(4)海水提溴要经过富集、氧化、提取的过程。其中氧化后生成的Br2可用Na2CO3溶液吸收,生成NaBr和NaBrO3及一种气体,写出该反应的化学方程式__________________。
(5)海水提取镁的过程中,得到MgCl2溶液后,先蒸发浓缩、冷却结晶、过滤制得MgCl2·6H2O,然后在HCl气流中加热得到MgCl2,而不是直接蒸发MgCl2溶液的原因是______________。
(6)海洋底部存在的可燃冰,是可开发的中药能源。常温常压下燃烧3.2g甲烷生成液态水,放出178kJ/mol的热量。写出甲烷燃烧的热化学方程式_________________。
-
海水是巨大的资源宝库,海水淡化及其综合利用具有重要意义。

请回答下列问题:
(1)步骤I中,粗盐中含有Ca2+、Mg2+、SO42-等杂质离子,粗盐精制过程中要使用Na2CO3溶液,请写出加入Na2CO3溶液后相关化学反应的离子方程式:_________________________。
(2)海水提溴,制得1molBr2至少需要消耗_________molCl2。步骤Ⅲ若用Na2SO3水溶液吸收Br2,有关反应的离子方程式为_________。
(3)用四氯化碳可以将生成的溴提取出来,利用了溴的________性质,为了除去产物中残留的少量Cl2,可向其中加入_________溶液。
-
(10分)海水是一种丰富的资源,工业上从海水中可提取许多种物质,广泛应用于生活、生产、科技等方面。下图是某工厂对海水资源进行综合利用的示意图。
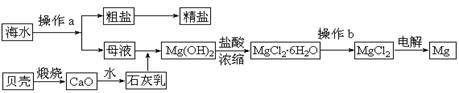
回答下列问题:
(1)流程图中操作a在蒸发结晶后进行(填操作名称)。
(2)工业上从海水中提取的NaCl,可用来制取纯缄,其简要过程如下:向饱和食盐水中
先通入气体A,后通入气体B,充分反应后过滤得到晶体C和滤液D,将晶体C灼烧即可制得纯碱。
①气体A、B是CO2或NH3,则气体A应是________(填化学式)。
②滤液D中主要含有NH4Cl、NaHCO3等物质,工业上是向滤液D中通入NH3,并加入细小食盐颗粒,冷却析出不含有NaHCO3的副产品NH4Cl晶体,则通入NH3的作用是 ________。
(3)镁是一种用途很广的金属材料,目前世界上60%的镁从海水中提取。
①若要验证所得无水MgCl2中不含NaCl,最简单的操作方法是:
________。
②操作b是在________氛围中进行,若在空气中加热,则会生成Mg(OH)Cl。
-
海水是一种丰富的资源,工业上可从海水中提取多种物质,广泛应用于生活、生产、科技等方面。下图是某工厂对海水资源进行综合利用的示意图。
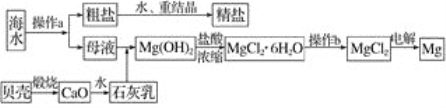
回答下列问题:
(1)流程图中操作a的名称为________。(填序号)
A、蒸发结晶 B、降温结晶
(2)生产生石灰的方程式__________________________。从离子反应的角度思考,往海水中加入石灰乳的作用是____________________。
(3)镁是一种用途很广的金属材料,目前世界上60%的镁从海水中提取。
①若要验证所得无水MgCl2中不含NaCl,最简单的操作方法是_____________。
②操作b是在________氛围中进行,若在空气中加热,则会生成Mg(OH)2,
写出有关反应的化学方程式:________________________________________。
(4)无水MgCl2在熔融状态下,通电后会产生Mg和Cl2,该反应的化学方程式为__________,从考虑成本和废物循环利用的角度,副产物氯气可以用于_______________。
-
海南省是海洋大省,海水是一种丰富的资源,工业上从海水中可提取许多种物质,广泛应用于生活、生产、科技等方面。下图是某工厂对海水资源进行综合利用的示意图。
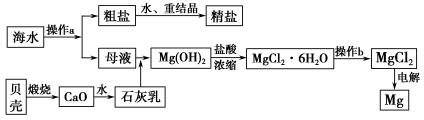
回答下列问题:
(1)流程图中操作a的名称为_________________________________________。
(2)工业上从海水中提取的NaCl,可用来制取纯碱,其简要过程如下:向饱和食盐水中先通入气体A,后通入气体B,充分反应后过滤得到晶体C和滤液D,将晶体C灼烧即可制得纯碱。
①则气体A应是_______________(填化学式),其过程反应方程式为_______________________________。
②滤液D中主要含有NH4Cl、NaHCO3等物质,工业上是向滤液D中通入NH3,并加入细小食盐颗粒,冷却析出不含有NaHCO3的副产品NH4Cl晶体,则通入NH3的作用是_______________________________________________。
(3)镁是一种用途很广的金属材料,目前世界上60%的镁从海水中提取。操作b是在__________气氛中进行,若在空气中加热,则会水解生成Mg(OH)Cl,写出有关反应的化学方程式_________________________________________。
(4)一氯碱厂每天消耗234吨NaCl,这些NaCl能生产质量分数为32%的烧碱溶液__________吨,同时转移__________mol电子。

 替代,请将Na2CO3溶液吸收Br2的反应化学方程式补充完整:____Br2+_____Na2CO3=_____NaBrO3+___________+________,________
替代,请将Na2CO3溶液吸收Br2的反应化学方程式补充完整:____Br2+_____Na2CO3=_____NaBrO3+___________+________,________

 Br2与Na2CO3反应的化学方程式补充完整:
Br2与Na2CO3反应的化学方程式补充完整: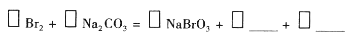 ___________
___________





