-
含有共价键的盐是( )
A.CaCl2 B.NaHS C.NH3·H2O D.Mg3N2
难度: 简单查看答案及解析
-
用下列实验装置进行相应实验,能达到实验目的的是
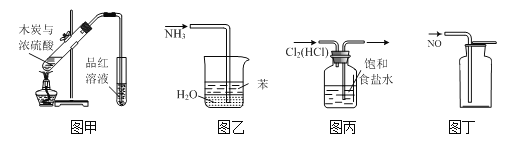
A.用图甲所示装置验证反应生成二氧化硫
B.用图乙装置吸收氨气并防止倒吸
C.用图丙装置除去氯气中的氯化氢
D.用装置丁收集NO
难度: 中等查看答案及解析
-
下列属于非电解质,溶于水又能导电的是
A.石墨 B.苯酚 C.氨气 D.过氧化钠
难度: 简单查看答案及解析
-
海水提溴过程中发生反应:3Br2+6Na2CO3+3H2O=5NaBr+NaBrO3+6NaHCO3,还原剂是( )
A.Br2 B.Na2CO3 C.H2O D.NaBr
难度: 简单查看答案及解析
-
下列物质的名称不正确的是( )
A.Na2CO3:纯碱
B.BaSO4:重晶石
C.
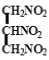 :硝化甘油
:硝化甘油D.
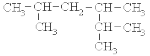 :2,3,5-三甲基已烷
:2,3,5-三甲基已烷难度: 简单查看答案及解析
-
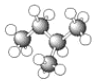
下列表示正确的是( )
A.异丁烷的球棍模型:
B.硫磺的分子式:S
C.碳碳双键的结构简式:C=C
D.二氧化碳分子的比例模型:

难度: 简单查看答案及解析
-
下列说法正确的是( )
A.锂电池、铅蓄电池、硅太阳能电池都属于化学电源
B.铝硅酸盐分子筛可用于物质分离,还可用作干燥剂、催化剂和催化剂载体
C.电热水器用镁棒防止内胆腐蚀,采用的是连接电源负极的阴极保护法
D.葡萄糖作为人类重要的能量来源,是由于它能发生水解
难度: 简单查看答案及解析
-
下列说法不正确的是( )
A.向NaBr溶液中加入氯水,再加入淀粉KI溶液,若溶液变蓝,则说明氧化性:Cl2>Br2>I2
B.护肤品中常含甘油等强亲水性物质
C.用二氧化碳与环氧丙烷制备的高聚物、PAL等产品的广泛使用将有效缓解白色污染
D.CH2(NH2)CH2COOH不是a-氨基酸,但它可以跟甘氨酸反应形成肽键
难度: 简单查看答案及解析
-
下列实验操作会使实验最终结果偏高的是
A.用湿润的pH 试纸测定NaOH的pH
B.配制100 mL 1.00 mol·L -1 NaCl溶液,定容时俯视刻度线
C.用0.0001 mol·L -1盐酸滴定20.00 mL NaOH溶液,起始读数时仰视
D.测定中和热的数值时,将0.5 mol·L -1NaOH溶液倒入盐酸后,立即读数
难度: 中等查看答案及解析
-
下列关于氮及其化合物说法,不正确的是( )
A.N2化学性质稳定,可用作保护气
B.NO、NO2均为大气污染气体,可在大气中相互转化
C.可用浓氨水检测输送氯气的管道是否发生泄漏
D.NaNO2具有氧化性,能使淀粉碘化钾溶液变蓝
难度: 中等查看答案及解析
-
不能正确表示下列变化的离子方程式是( )
A.NaHCO3溶液与AlCl3溶液反应:3
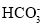 +Al3+=Al(OH)3↓+3CO2↑
+Al3+=Al(OH)3↓+3CO2↑B.KClO碱性溶液与Fe(OH)3反应:3ClO-+2Fe(OH)3=2
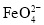 +3Cl-+4H++H2O
+3Cl-+4H++H2OC.硬脂酸钠溶液显碱性:C17H35COO-+H2O⇌C17H35COOH+OH-
D.肼的电离:N2H4+H2O⇌
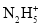 +OH-
+OH-难度: 困难查看答案及解析
-
下列说法不正确的是( )
A.纤维二糖、麦芽糖、乳糖互为同分异构体,都能发生银镜反应
B.利用燃烧现象可以区别聚乙烯、聚氯乙烯
C.环已烷中所有C—C—C键角均为120°
D.聚乙烯塑料在日光照射下易老化是因为发生了氧化反应
难度: 中等查看答案及解析
-
合成高分子金属离子螯合剂的反应:
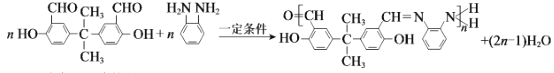
下列说法不正确的是( )
A.聚合物应避免与碱性物质(如NaOH)长期接触
B.聚合物的合成反应为缩聚反应
C.1mol聚合物与足量银氨溶液作用可析出2nmolAg
D.通过质谱法测定其平均相对分子质量,可得其聚合度
难度: 中等查看答案及解析
-
室温下,分别用0.1mol/L溶液进行下列实验,结论不正确的是
A.向
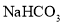 溶液中通
溶液中通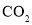 至
至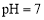 :c(Na+)=c(HCO3-)+ 2c(CO32-)
:c(Na+)=c(HCO3-)+ 2c(CO32-)B.向
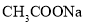 溶液中加入等浓度等体积的盐酸:c(Na+)=c(Cl-)
溶液中加入等浓度等体积的盐酸:c(Na+)=c(Cl-)C.向
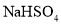 溶液中加入等浓度等体积的
溶液中加入等浓度等体积的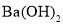 溶液:pH=13
溶液:pH=13D.向氨水中加入少量
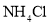 固体:
固体: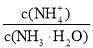 增大
增大难度: 中等查看答案及解析
-
CO2的固定和转化是世界性课题。某大学研究团队巧妙设计构建了系列新型光电催化人工合成体系一光电催化池,p-n半导体异质结催化CO2在水中直接制备长碳链有机物石蜡(Paraffin)并放出氧气,原理如图:
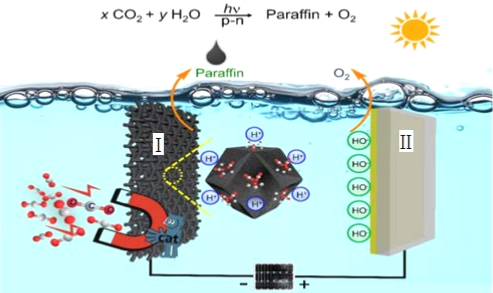
下列说法不正确的是()
A.电极I的电势比电极II的电势高
B.该设计能实现光能、电能同时向化学能转化
C.电子从负极流到电极I,从电极II流到正极
D.阴极区,p-n为催化剂,CO2发生还原反应生成长碳链有机物
难度: 中等查看答案及解析
-
反应Ⅰ、Ⅱ、Ⅲ均会在工业生产硝酸过程中发生,其中反应Ⅰ、Ⅱ发生在氧化炉中,反应Ⅲ发生在氧化塔中,不同温度下各反应的化学平衡常数如下表所示。下列说法正确的是
温度
(K)
化学平衡常数
反应Ⅰ: 4NH3 + 5O2 → 4NO + 6H2O
反应Ⅱ: 4NH3 + 3O2 → 2N2 + 6H2O
反应Ⅲ: 2NO + O2 → 2NO2
500
1.1×1026
7.1×1034
1.3×102
700
2.1×1019
2.6×1025
1.0
A.使用选择性催化反应Ⅰ的催化剂可增大氧化炉中NO的含量
B.通过改变氧化炉的温度可促进反应Ⅰ而抑制反应Ⅱ
C.通过改变氧化炉的压强可促进反应Ⅰ而抑制反应Ⅱ
D.氧化炉出气在进入氧化塔前应进一步提高温度
难度: 中等查看答案及解析
-
设[aX+bY]为a个X微粒和b个Y微粒组成的一个微粒集合体,NA为阿伏加德罗常数的值。下列说法正确的是( )
A.标准状况下,1个氧气分子体积为
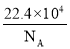 cm3
cm3B.在反应4Cl2+8NaOH=6NaCl+NaClO+NaClO3+4H2O中,发生lmol电子转移时,生成氧化产物[ClO-+
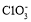 ]的总数为1/3NA
]的总数为1/3NAC.标准状况下22.4LCl2完全溶于水时,所得溶液中含氯微粒总数为2NA
D.NaCl晶体中Na+与最近Cl-的核间距离为acm,则其晶体密度为
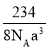 g/cm3
g/cm3难度: 困难查看答案及解析
-
恒温恒容下,向2 L密闭容器中加入MgSO4(s)和CO(g),发生反应:MgSO4(s)+CO(g)
 MgO(s)+CO2(g)+SO2(g),反应过程中测定的部分数据见下表:
MgO(s)+CO2(g)+SO2(g),反应过程中测定的部分数据见下表:反应时间/min
n(MgSO4)/mol
n(CO)/mol
n(SO2) / mol
0
2.0
2.0
0
2
0.8
4
1.2
6
1.2
2.8
下列说法正确的是
A.0~2 min内的平均速率为υ (CO)=0.6 mol/(L·min)
B.4 min后,平衡移动的原因可能是再向容器中加入了2.0 mol的SO2
C.若升高温度,反应的平衡常数变为1.0,则正反应为放热反应
D.若其他条件不变,起始时容器中MgSO4、CO均为1.0 mol,则平衡时n(SO2)=0.6 mol
难度: 中等查看答案及解析
-
次磷酸(H3PO2)是一种精细磷化工产品,有强还原性。已知:①2P4+3Ba(OH)2+6H2O=3Ba(H2PO2)2+2PH3↑;②H3PO2+NaOH(足量)=NaH2PO2+H2O。下列推断不正确的是( )
A.H3PO2的结构式为
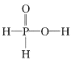
B.H3PO2具有强还原性,在空气中可能被氧化成磷酸
C.NaH2PO2是正盐
D.每消耗1molP4,反应中转移6mol电子
难度: 中等查看答案及解析
-
乙炔在Pd表面选择加氢的反应机理如图所示。其中吸附在Pd表面上的物种用*标注。
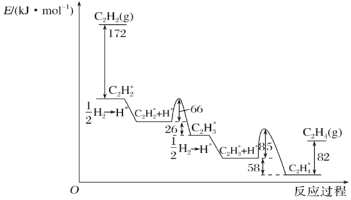
下列有关说法正确的是( )
A.乙炔催化加氢反应为吸热反应
B.该正反应历程中最大能垒(活化能)为85kJ/mol
C.Pd为固体催化剂,其表面积大小对催化效果无影响
D.C2H2*+H*→C2H3*只有化学键的形成过程
难度: 中等查看答案及解析
-
某温度下,向一定体积0.1mol/L氨水中逐滴加入相同浓度的盐酸,溶液中pH与pOH的变化关系如图所示。下列说法错误的是( )
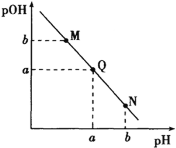
A.此温度下,水的离子积常数为1.0×10-2a
B.N点溶液加水稀释,
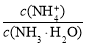 增大
增大C.M、Q、N三点所示的溶液中均存在:c(NH
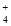 )+c(H+)=c(OH-)+c(Cl-)
)+c(H+)=c(OH-)+c(Cl-)D.Q点消耗的盐酸的体积等于氨水的体积
难度: 中等查看答案及解析
-
某无色溶液由K+、Fe3+、Ag+、Al3+、
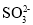 、
、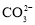 、
、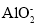 、
、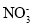 、S2-、
、S2-、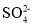 中的若干种组成。取适量该溶液进行如下实验:①加入过量HBr,生成无色气体甲和淡黄色沉淀甲;②取①所得的溶液加入过量NH4HCO3溶液,生成无色气体乙和白色沉淀乙;③取②所得的溶液,加入过量Ba(OH)2,生成无色气体丙和白色沉淀丙,下列说法正确的是
中的若干种组成。取适量该溶液进行如下实验:①加入过量HBr,生成无色气体甲和淡黄色沉淀甲;②取①所得的溶液加入过量NH4HCO3溶液,生成无色气体乙和白色沉淀乙;③取②所得的溶液,加入过量Ba(OH)2,生成无色气体丙和白色沉淀丙,下列说法正确的是A.该溶液中可能存在
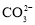 和
和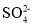 ,一定不存在Fe3+、Ag+和Al3+
,一定不存在Fe3+、Ag+和Al3+B.气体甲的成分有3种可能性
C.生成沉淀甲可能是AgBr或是S
D.为了确定该溶液中是否存在
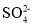 ,直接用盐酸酸化的BaCl2溶液来检验
,直接用盐酸酸化的BaCl2溶液来检验难度: 困难查看答案及解析
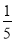 体积的甲烷和
体积的甲烷和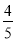 体积的氯气,再用强光照射瓶中气体完成甲烷与氯气的取代反应
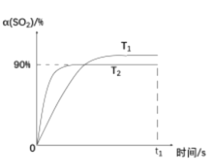
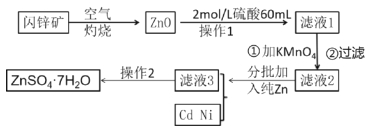
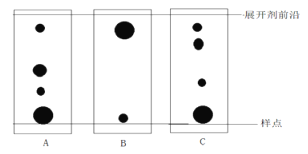
体积的氯气,再用强光照射瓶中气体完成甲烷与氯气的取代反应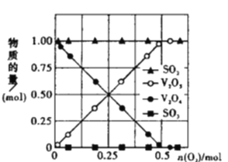
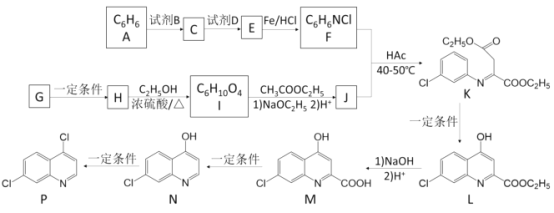
 CH3COCH2COOC2H5
CH3COCH2COOC2H5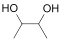 为原料制备X(
为原料制备X(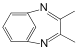 )的合成路线(用流程图表示,无机试剂任选)________。
)的合成路线(用流程图表示,无机试剂任选)________。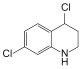 ),写出同时符合下列条件的Q的同分异构体的结构简式______。
),写出同时符合下列条件的Q的同分异构体的结构简式______。