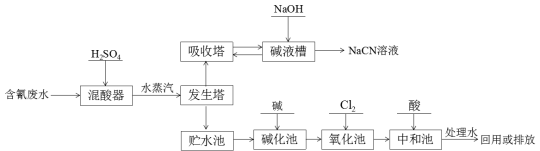
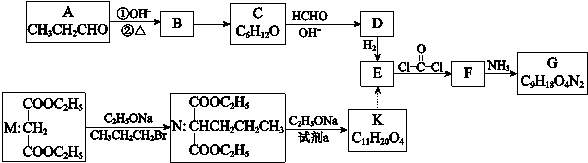
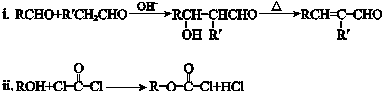
-
下列说法不正确的是
A.天津港爆炸案中对剧毒的氰化钠(NaCN)喷洒双氧水消毒,利用了双氧水的氧化性
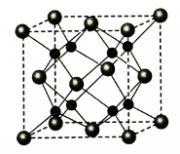
B.碳酸钙分解、氢氧化钡晶体和氯化铵固体反应、高温下铝与氧化铁反应都是吸热反应
C.刚玉、红宝石主要成分是氧化铝,陶瓷、分子筛主要成分是硅酸盐
D.石油原油的脱水,有色玻璃、纳米材料、塑料、橡胶及合成纤维等制造过程都会用到胶体
难度: 简单查看答案及解析
-
NA为阿伏伽德罗常数的值。下列说法正确的是
A.1 mol Cu和足量热浓硫酸反应可生成NA个SO3分子
B.3 mol单质Fe完全转变为Fe3O4,失去8 NA个电子
C.过氧化钠与水反应时,生成0.1 mol氧气转移的电子数为0.4 NA
D.密闭容器中2 mol NO与1 mol O2充分反应,产物的分子数为2 NA
难度: 中等查看答案及解析
-
有机物TPE具有聚集诱导发光特性,在光电材料领域应用前景广阔,其结构简式如图所示,下列说法正确的是
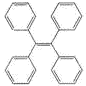
A.该有机物的分子式为C26 H22
B.该有机物属于苯的同系物
C.该有机物的一氯代物有4种
D.该有机物既可发生氧化反应,又可发生还原反应
难度: 中等查看答案及解析
-
能正确表示下列反应的离子方程式是
A.Fe(NO3)3溶液中加入过量HI溶液:2Fe3+ + 2I- = 2Fe2+ + I2
B.浓烧碱溶液中加入铝片:2A1 + 2OH- = 2AlO2- + H2
C.H2SO4与Ba(OH)2溶液反应:Ba2+ + OH- + H+ + SO42- = BaSO4 + H2O
D.将新制氢氧化铜悬浊液加入氨水中:Cu(OH)2 + 4NH3·H2O = [Cu(NH3)4]2+ + 2OH- + 4H2O
难度: 中等查看答案及解析
-
工业上可利用下图所示电解装置吸收和转化SO2(A、B为惰性电极)。则说法正确的是
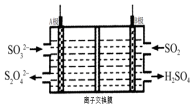
A.A电极接电源的正极
B.A极区溶液的碱性逐渐增强
C.本装置中使用的是阴离子交换膜
D.B极的电极反应式为SO2+2e-+2H2O == SO42-+4H+
难度: 中等查看答案及解析
-
常温下,下列有关醋酸溶液的叙述中不正确的是
A.pH =4.3的CH3COOH与CH3COONa混合溶液中:c(Na+) < c(CH3COO-)
B.浓度为0.2 mol/L的CH3COOH溶液和浓度为0.1 mol/L的NaOH溶液等体积混合后:
c(CH3COO -) - c(CH3COOH) = 2[c(H+) - c(OH-)]
C.醋酸浓溶液加少量水稀释,
几乎不变
D.含等物质的量的NaHC2O4和Na2C2O4的溶液:3c(Na+) = 2[c(HC2O4-) + c(C2O42-) + c(H2C2O4)]
难度: 困难查看答案及解析
-
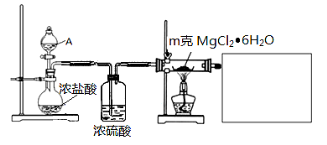
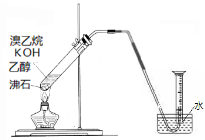
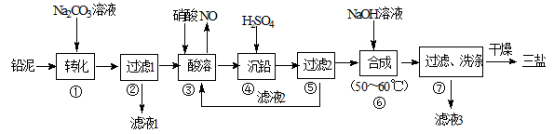
关于下列各实验装置图的叙述中,正确的是
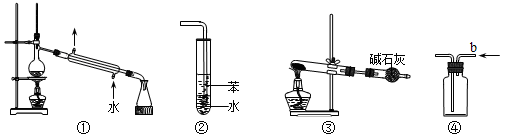
A.装置①可用于分离苯和溴苯的混合物
B.装置②可用于吸收HCl或NH3气体
C.装置③可用于分解NH4Cl制备NH3
D.装置④b口进气可收集CO2或NO气体
难度: 中等查看答案及解析