-
氮可形成多种气态氧化物,如NO、NO2、N2O4等。已知NO2和N2O4的结构式分别是 和
和  。实验测得N-N键的键能为167kJ·mol-1,NO2中氮氧键的键能为 466 kJ·mol-1,N2O4中氮氧键的键能为438.5 kJ·mol-1。
。实验测得N-N键的键能为167kJ·mol-1,NO2中氮氧键的键能为 466 kJ·mol-1,N2O4中氮氧键的键能为438.5 kJ·mol-1。
(1)写出N2O4转化NO2为的热化学方程式 。
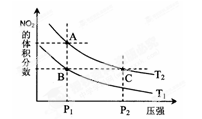
(2)对反应N2O4 (g) 2 NO2(g),在温度T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如下图所示。
2 NO2(g),在温度T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如下图所示。

①A、C两点的反应速率v(A) v(C)(填“﹥”“=”或“<”)。
②B、C两点的气体平均相对分子质量M(B) M(C)(填“﹥”、“=”或“<”)。
③由状态B到达状态A可用的方法是 。
④A点气体的颜色比C点 (填“深”、“浅”或“相同”),原因是 。
(3)在100℃时,将0.40mol的NO2气体充入 2L 的密闭容器中,每隔一定时间就对该容器内的物质进行分析,得到下表所示数据。
| 时间/s | 0 | 20 | 40 | 60 | 80 |
| n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
| n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
①在上述条件下,从反应开始直至20s时,v(NO2)= mol·L-1·s-1。
②若在相同的情况下最初向该容器充入的是N2O4气体,要达到上述同样的平衡状态, N2O4的起始浓度应是 mol·L-1。
-
(14分)氮可形成多种氧化物,如NO、NO2、N2O4等。已知NO2和N2O4的结构式分别是 和
和 。实验测得N-N键键能为167kJ·mol-1, NO2中氮氧键的平均键能为466 kJ·mol-1,N2O4中氮氧键的平均键能为438.5 kJ·mol-1。
。实验测得N-N键键能为167kJ·mol-1, NO2中氮氧键的平均键能为466 kJ·mol-1,N2O4中氮氧键的平均键能为438.5 kJ·mol-1。
(1)写出N2O4转化为NO2的热化学方程式:____________
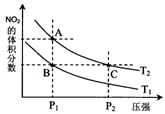
(2)对反应N2O4(g) 2NO2(g),在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是_____
2NO2(g),在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是_____
A.A、C两点的反应速率:A>C
B.B、C两点的气体的平均相对分子质量:B<C
C.A、C两点气体的颜色:A深,C浅
D.由状态B到状态A,可以用加热的方法
(3)在100℃时,将0.40mol的NO2气体充入2 L抽空的密闭容器中,每隔一定时间就对该容器内的物质进行分析,得到如下表数据:
| 时间(s) | 0 | 20 | 40 | 60 | 80 |
| n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
| n(N2O4)/mol | 0.00 | 0.050 | n2 | 0.080 | 0.080 |
①在上述条件下,从反应开始直至20 s时,二氧化氮的平均反应速率为____________
②n3 n4(填“>”、“<”或“=”),该反应的平衡常数K的值为 ,升高温度后,反应2NO2 N2O4的平衡常数K将 (填“增大”、“减小”或“不变”)。
N2O4的平衡常数K将 (填“增大”、“减小”或“不变”)。
③若在相同情况下最初向该容器充入的是N2O4气体,要达到上述同样的平衡状态,N2O4的起始浓度是_____________mol·L-1。
-
氮可形成多种氧化物,如NO、NO2、N2O4等。已知NO2和N2O4的结构式分别是 和
和 。实验测得N-N键键能为167kJ·mol-1, NO2中氮氧键的平均键能为466 kJ·mol-1,N2O4中氮氧键的平均键能为438.5 kJ·mol-1。
。实验测得N-N键键能为167kJ·mol-1, NO2中氮氧键的平均键能为466 kJ·mol-1,N2O4中氮氧键的平均键能为438.5 kJ·mol-1。
(1)写出N2O4转化为NO2的热化学方程式:________
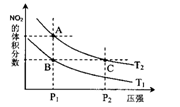
(2)对反应N2O4(g) 2NO2(g),在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是________
2NO2(g),在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是________
A.A、C两点的反应速率:A>C
B.B、C两点的气体的平均相对分子质量:B<C
C.A、C两点气体的颜色:A深,C浅
D.由状态B到状态A,可以用加热的方法
(3)在100℃时,将0.40mol的NO2气体充入2 L抽空的密闭容器中,每隔一定时间就对该容器内的物质进行分析,得到如下表数据:
| 时间(s) | 0 | 20 | 40 | 60 | 80 |
| n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
| n(N2O4)/mol | 0.00 | 0.050 | n2 | 0.080 | 0.080 |
①在上述条件下,从反应开始直至20 s时,二氧化氮的平均反应速率为________
②n3n4(填“>”、“<”或“=”),该反应的平衡常数K的值为,升高温度后,反应2NO2 N2O4的平衡常数K将________(填“增大”、“减小”或“不变”)。
N2O4的平衡常数K将________(填“增大”、“减小”或“不变”)。
③若在相同情况下最初向该容器充入的是N2O4气体,要达到上述同样的平衡状态,N2O4的起始浓度是_____________mol·L-1。
-
氮可形成多种氧化物,如NO、NO2、N2O4等。已知NO2和N2O4的结构式分别是 和
和 。实验测得N-N键键能167kJ·mol-1,NO2中氮氧键的平均键能466 kJ·mol-1,N2O4中氮氧键的平均键能为438.5 kJ·mol-1。
。实验测得N-N键键能167kJ·mol-1,NO2中氮氧键的平均键能466 kJ·mol-1,N2O4中氮氧键的平均键能为438.5 kJ·mol-1。
(1)写出N2O4转化为NO2的热化学方程式_________________________
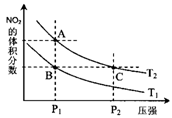
(2)对反应N2O4(g) 2NO2(g),在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是
2NO2(g),在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是
A.A、C两点的反应速率:A>C
B.B、C两点的气体的平均相对分子质量:B<C
C.A、C两点气体的颜色:A深,C浅
D.由状态B到状态A,可以用加热的方法
(3)在100℃时,将0.400mol的NO2气体充入2 L抽空的密闭容器中,每隔一定时间就对该容器内的物质进行分析,得到如下表数据:
| 时间(s) | 0 | 20 | 40 | 60 | 80 |
| n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
| n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
①在上述条件下,从反应开始直至20 s时,二氧化氮的平均反应速率为_____mol·(L·s)-1。
②n3________ n4(填“>”、“<”或“=”),该反应的平衡常数K的值为,升高温度后,反应2NO2 N2O4的平衡常数K将________(填“增大”、“减小”或“不变”)。
N2O4的平衡常数K将________(填“增大”、“减小”或“不变”)。
③若在相同情况下最初向该容器充入的是N2O4气体,要达到上述同样的平衡状态,N2O4的起始浓度是_____________mol·L-1。
④计算③中条件下达到平衡后混合气体的平均相对分子质量为____________。(结果保留小数点后一位)
-
(15分)非金属元素氮有多种氧化物,如NO、NO2、N2O4等。已知NO2和N2O4的结构式分别是 和
和 。实验测得N-N键键能为167kJ·mol-1,NO2中氮氧双键的平均键能为466 kJ·mol-1,N2O4中氮氧双键的平均键能为438.5 kJ·mol-1。
。实验测得N-N键键能为167kJ·mol-1,NO2中氮氧双键的平均键能为466 kJ·mol-1,N2O4中氮氧双键的平均键能为438.5 kJ·mol-1。
(1)写出NO2转化为N2O4的热化学方程式_________________________________________
(2)对反应2NO2 (g) N2O4 (g),在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是( )
N2O4 (g),在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是( )
A.A、C两点的反应速率:A>C
B.B、C两点的气体的平均相对分子质量:B<C
C.A、C两点气体的颜色:A深,C浅
D.由状态B到状态A,可以用加热的方法
(3)在100℃时,将0.400mol的NO2气体充入2 L抽空的密闭容器中,每隔一定时间就对该容器内的物质进行分析,得到如下表数据:
| 时间(s) | 0 | 20 | 40 | 60 | 80 |
| n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
| n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
①在上述条件下,从反应开始直至20 s时,二氧化氮的平均反应速率为_____________。
②2NO2(g) N2O4(g)该反应的平衡常数K的值为________;若100℃时的某时刻测得c(NO2)=1.00mol/L,c(N2O4)=0.20mol/L,则该时刻的v正 v逆(填“>”、“<”或“=”),升高温度后,反应2NO2
N2O4(g)该反应的平衡常数K的值为________;若100℃时的某时刻测得c(NO2)=1.00mol/L,c(N2O4)=0.20mol/L,则该时刻的v正 v逆(填“>”、“<”或“=”),升高温度后,反应2NO2 N2O4的平衡常数K将________(填“增大”、“减小”或“不变”)。
N2O4的平衡常数K将________(填“增大”、“减小”或“不变”)。
③若在相同情况下最初向该容器充入的是N2O4气体,要达到上述同样的平衡状态,N2O4的起始浓度是_____________mol·L-1。
④计算③中条件下达到平衡后混合气体的平均相对分子质量为____________。(结果保留小数点后一位)
-
氮可形成多种氧化物,如NO、NO2、N2O4等.
(1)对反应N2O4(g) 2NO2(g),在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示.下列说法正确的是________
2NO2(g),在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示.下列说法正确的是________
A.A,C两点的反应速率:A>C
B.B,C两点的气体的平均相对分子质量:B<C
C.A,C两点气体的颜色:A深,C浅
D.由状态B到状态A,可以用加热的方法
(2)在100℃时,将0.40mol的NO2气体充入2L抽空的密闭容器中,每隔一定时间就对该容器内的物质进行分析,得到如下表数据:
| 时间(s) | | 20 | 40 | 60 | 80 |
| n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
| n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
①在上述条件下,从反应开始直至20s时,二氧化氮的平均反应速率为________mol•-1.
②n3________n4(填“>”、“<”或“=”),该反应的平衡常数K的值为________,升高温度后,反应2NO2 N2O4的平衡常数K将________(填“增大”、“减小”或“不变”).
N2O4的平衡常数K将________(填“增大”、“减小”或“不变”).
③若在相同情况下最初向该容器充入的是N2O4气体,要达到上述同样的平衡状态,N2O4的起始浓度是________mol•L-1.
④计算③中条件下达到平衡后混合气体的平均相对分子质量为多少.(结果保留小数点后一位)

-
常温常压下,甲、乙两容器带有相同质量的活塞且容积相等,
甲容器中盛有二氧化氮气体,乙容器中盛有空气,现分别进
行下列两实验:(已知:N2O4(g) 2NO2(g) △H > 0)
2NO2(g) △H > 0)

(a)将两容器置于沸水中加热
(b)在活塞上都加1 kg的砝码
在以上两情况下,甲和乙容器的体积大小的比较,正确的是
A.(a)甲>乙,(b)甲>乙 B.(a)甲>乙,(b)甲=乙
C.(a)甲<乙,(b)甲>乙 D.(a)甲>乙,(b)甲<乙
-
氮是一种重要的非金属元素,可以形成多种不同类型的化合物,请根据要求回答下列问题:
(1)已知NA表示阿伏加德罗常数,在69g NO2和N2O4的混合气体中含有____NA个氧原子;在2L 0.6 mol/LFe(NO3)3溶液中含_____NA个NO3-离子。
(2)三氟化氮(NF3)是一种无色无味的气体,它是微电子工业技术的关键原料之一,三氟化氮在潮湿的空气中与水蒸气能发生氧化还原反应,其反应的产物有:HF、NO和HNO3,
①写出该反应的化学方程式 .若反应中生成0.15 mol HNO3,则该反应中转移的电子数目为 个。
②三氟化氮可由氨气和氟气反应得到:4NH3+3F2=NF3+3NH4F;据题意推测 NF3, F2, NO这三种气体中,氧化性由强到弱的顺序为 。
(3)氨和联氨(N2H4)是氮的两种常见化合物,制备联氨可用丙酮为催化剂,将次氯酸钠与氨气反应,该反应中还原剂与氧化剂的物质的量之比为2:1,写出该反应的化学方程式 。
-
工业废气和汽车尾气含有多种氮氧化物,以NOx表示,NOx能破坏臭氧层,产生光化学烟雾,是造成大气污染的来源之一。按要求回答下列问题:
(1)NO2与N2O4存在以下转化关系:2NO2(g) N2O4(g)。
N2O4(g)。
①已知:标准状况(25℃、101kPa)下,由最稳定的单质生成1mol化合物的焓变(或反应热),称为该化合物的标准摩尔生成焓。几种氧化物的标准摩尔生成焓如表所示:
| 物质 | NO(g) | NO2(g) | N2O4(g) | CO(g) |
| 标准摩尔生成焓/(kJ·mol-1) | 90.25 | 33.18 | 9.16 | -110.53 |
则NO2转化成N2O4的热化学方程式为__。
②将一定量N2O4投入固定容积的恒温容器中,下述现象能说明反应达到平衡状态的是__(填标号)。
A.v(N2O4)=2v(NO2) B.气体的密度不变
C. 不变 D.气体的平均相对分子质量不变
不变 D.气体的平均相对分子质量不变
③达到平衡后,保持温度不变,将气体体积压缩到原来的一半,再次达到平衡时,混合气体颜色____填“变深”“变浅”或“不变”),判断理由是___。
(2)在容积均为2L的甲、乙两个恒容密闭容器中,分别充入等量NO2,发生反应:2NO2(g) 2NO(g)+O2(g)。保持温度分别为T1、T2,测得
2NO(g)+O2(g)。保持温度分别为T1、T2,测得 n(NO2)与n(O2)随时间的变化如图所示:
n(NO2)与n(O2)随时间的变化如图所示:
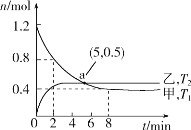
①T1时,反应从开始到第2min,平均速率v(O2)=__,该温度下平衡常数K=__。
②实验测得:v正=k正c2(NO2),v逆=k逆c2(NO)·c(O2),k正、k逆为速率常数,受温度影响,下列有关说法正确的是__(填标号)。
A.反应正向放热
B.a点处,v逆(甲)<v逆(乙)
C.k正(T2)>k正(T1)
D.温度改变,k正与k逆的比值不变
(3)硫代硫酸钠(Na2S2O3)在碱性溶液中是较强的还原剂,可用于净化氧化度较高的NOx废气,使之转化为无毒、无污染的N2。请写出NO2与硫代硫酸钠碱性溶液反应的离子方程式:__。
-
将22.4L某气态氮氧化合物与足量的灼热铜粉完全反应后,气体体积11.2L(体积均在相同条件下测定),则该氮氧化合物的化学式为( )
A.NO2
B.N2O2
C.N2O
D.N2O4
和
。实验测得N-N键的键能为167kJ·mol-1,NO2中氮氧键的键能为 466 kJ·mol-1,N2O4中氮氧键的键能为438.5 kJ·mol-1。
2 NO2(g),在温度T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如下图所示。






