-
(化学——选修3:物质结构与性质)A、B、C、D为原子序数依次增大的四种元素,A2-和B+具有相同的电子构型;C、D为同周期元素,C核外电子总数是最外层电子数的3倍;D元素最外层有一个未成对电子。回答下列问题:
(1)四种元素中第一电离能最大的是_________(填元素符号),其中C原子的核外电子排布式为:_________________;
(2)A有两种同素异形体,其中沸点较高的是______(填分子式),B的氢化物所属的晶体类型为___________;
(3)化合物CD3中心原子的杂化轨道类型为_________________;
(4)化合物D2A的立体构型为____________,单质D与湿润的Na2CO3反应可制备D2A,其化学方程式为_________________________________________;
(5)CuSO4溶液可用作C4中毒的解毒剂,反应可生成C的最高价含氧酸和铜,该反应的化学方程式为:________________________________________;
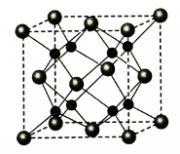
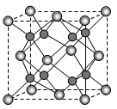
(6)A和B形成化合物F,晶胞结构如图所示,晶胞参致a=0.566nm,晶胞中A原子的配位数为_________,列出晶体F的密度(g·cm-3)计算式________________________。(阿伏加德罗常数的值为NA)
-
[化学—选修3:物质结构与性质]A、B、C、D为原子序数依次增大的四种元素,A2-和B2+具有相同的电子构型;C、D为同周期元索,C核外电子总数是最外层电子数的3倍;D元素最外层有一个未成对电子。回答下列问题:
(1)四种元素中电负性最大的是 (填元素符号),其中C原子的次外层电子排布式为 。
(2)单质A有两种同素异形体,其中沸点高的是 (填分子式),原因是 ;B的氢化物所属的晶体类型是 ,B单质所形成的晶体,一个晶胞平均含有 个原子。
(3)C和D反应可生成组成比为1:5的化合物E,E的分子式为 ,已知该分子的空间构型为三角双锥,则其中两个Cl原子被F原子所替代得到的产物结构有 种。
(4)化合物D2A的立体构型为 ,中心原子的价层电子对数为 ,单质D与Na2SO3溶液反应,其离子方程式为 。
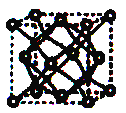
(5)A和B能够形成化合物F,F晶体中的B2+离子的排列方式如图所示,
①每个B2+周围最近的等距离的B2+离子有 个。
②已知F的晶胞参数是a0=0.54nm,它的密度为 (只列式不作计算,阿伏加德罗常数为6.02×1023mol-1)。
-
【化学—选修2:物质结构与性质】A、B、C、D为原子序数依次增大的四种元素,A2-和B+具有相同的电子构型;C、D为同周期元素,C核外电子总数是最外层电子数的3倍;D元素最外层有一个未成对电子。回答下列问题:
(1)四种元素中电负性最大的是________(填元素符号),其中C原子的核外电子排布式为________;
(2)单质A有两种同素异形体,其中沸点高的是________(填分子式),原因是________;A和B的氢化物所属的晶体类型分别为______和_______;
(3)C和D反应可生成组成比为1:3的化合物E,E的立体构型为________,中心原子的杂化轨道类型_______;
(4)化合物D2A的立体构型为________,中心原子的价层电子对数为________,单质D与湿润的Na2CO3反应可制备D2A,其化学方程式为_______;
(5)A和B能够形成化合物F,其晶胞结构如图所示,晶胞参数a=0.566nm,F的化学式为________,晶胞中A原子的配位数为_______;列式计算晶体F的密度_______。
-
【化学—选修3:物质结构与性质】A、B、C、D为原子序数依次增大的四种元素,A2﹣和B+具有相同的电子构型;C、D为同周期元素,C核外电子总数是最外层电子数的3倍;D元素最外层有一个未成对电子。回答下列问题:
(1)四种元素中电负性最大的是 (填元素符号),其中C原子的核外电子排布式为 ;
(2)单质A有两种同素异形体,其中沸点高的是 (填分子式),原因是 ,A和B 的氢化物所属的晶体类型分别为 和 ;
(3)C和D反应可生成组成比为1︰3的化合物E, E的立体构型为 ,中心原子的杂化轨道类型为 ;
(4)A和B能够形成化合物F,其晶胞结构如图所示,晶胞参数,a = 0.566 nm,F的化学式为 ,列式计算晶体F的密度(g.cm-3) 。
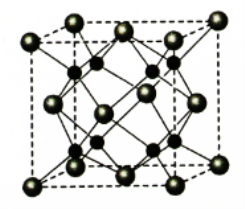
-
[化学—选修3:物质结构与性质] A、B、C、D为原子序数依次增大的四种元素,A2-和B2+具有相同的电子构型;C、 D为同周期元索,C核外电子总数是最外层电子数的3倍;D元素最外层有一个未成对电子。回答下列问题:
(1)四种元素中电负性最大的是________(填元素符号),其中C原子的次外层电子排布式为_____________________________。
(2)单质A有两种同素异形体,其中沸点高的是______(填分子式),原因是___________________;B的氢化物所属的晶体类型是_____________,B单质所形成的晶体,一个晶胞平均含有_____________个原子。
(3)C和D反应可生成组成比为1:5的化合物E, E的分子式为_______,已知该分子的空间构型为三角双锥,则其中两个Cl原子被F原子所替代得到的产物结构有________种。
(4)化合物D2A的立体构型为______________,中心原子的价层电子对数为_______,单质D与Na2SO3溶液反应,其离子方程式为__________________________________________。
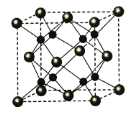
(5)A和B能够形成化合物F,F晶体中的B2+离子的排列方式如下图所示,
①每个B2+周围最近的等距离的A2-离子有_____________个。
②已知F的晶胞参数是a0=0.54nm,它的密度为________________________(只列式不作计算,阿伏加德罗常数为6.02×1023mol-1)。
-
(化学——选修3:物质结构与性质)
A、B、C、D为原子序数依次增大的四种元索,A2-和B+具有相同的电子构型;C、 D为同周期元索,C核外电子总数是最外层电子数的3倍;D元素最外层有一个未成对电子。回答下列问题:
(1)四种元素中电负性最大的是______(填元素符号),其中D原子的核外电子排布式为__________。
(2)单质A有两种同素异形体,其中沸点高的是______(填分子式),原因是________;B和D的氢化物所属的晶体类型分别为_______和_______。
(3)C和D反应可生成组成比为1:3的化合物E, E的立体构型为_______,中心原子的杂化轨道类型为_______,中心原子的价层电子对数为_____________。
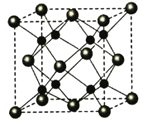
(4)A和B能够形成化合物F,其晶胞结构如图所示,晶胞参数,a=0.566nm, 列式计算晶体F的密度(g.cm-3)______________________________。
-
[化学—选修3:物质结构与性质](15分)A、B、C、D为原子序数依次增大的四种元索,A2-和B+具有相同的电子构型;C、 D为同周期元索,C核外电子总数是最外层电子数的3倍;D元素最外层有一个未成对电子。回答下列问题:
(1)四种元素中电负性最大的是 (填元素符号),其中C原子的核外电子排布式为__________。
(2)单质A有两种同素异形体,其中沸点高的是 (填分子式),原因是 ;A和B的氢化物所属的晶体类型分别为 和 。
(3)C和D反应可生成组成比为1:3的化合物E, E的立体构型为 ,中心原子的杂化轨道类型为 。
(4)化合物D2A的立体构型为 ,中心原子的价层电子对数为 ,单质D与湿润的Na2CO3反应可制备D2A,其化学方程式为 。
(5)A和B能够形成化合物F,其晶胞结构如图所示,晶胞参数,a=0.566nm, F 的化学式为 :晶胞中A 原子的配位数为 ;列式计算晶体F的密度(g.cm-3) 。
-
[化学—选修3:物质结构与性质](15分)A、B、C、D为原子序数依次增大的四种元索,A2-和B+具有相同的电子构型;C、 D为同周期元索,C核外电子总数是最外层电子数的3倍;D元素最外层有一个未成对电子。回答下列问题:
(1)四种元素中电负性最大的是 (填元素符号),其中C原子的核外电子排布式为__________。
(2)单质A有两种同素异形体,其中沸点高的是 (填分子式),原因是 ;A和B的氢化物所属的晶体类型分别为 和 。
(3)C和D反应可生成组成比为1:3的化合物E, E的立体构型为 ,中心原子的杂化轨道类型为 。
(4)化合物D2A的立体构型为 ,中心原子的价层电子对数为 ,单质D与湿润的Na2CO3反应可制备D2A,其化学方程式为 。
(5)A和B能够形成化合物F,其晶胞结构如图所示,晶胞参数,a=0.566nm, F 的化学式为 :晶胞中A 原子的配位数为 ;列式计算晶体F的密度(g.cm-3) 。
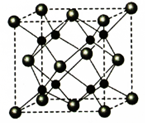
-
A、B、C、D为原子序数依次增大的四种元素,A2-和B+具有相同的电子构型;C、D为同周期元素,C核外电子总数是最外层电子数的3倍;D元素最外层有一个未成对电子。回答下列问题:
(1)四种元素中电负性最大的是________(填元素符号),其中C原子的核外电子排布式为__________________。
(2)单质A有两种同素异形体,其中沸点高的是______(填分子式),原因是__________________________________________;A和B的氢化物所属的晶体类型分别为________和________。
(3)C和D反应可生成组成比为1∶3的化合物E,E的立体构型为______________,中心原子的杂化轨道类型为________。
(4)化合物D2A的立体构型为________,单质D与湿润的Na2CO3反应可制备D2A,其化学方程式为_______________________________________________。
(5)A和B能够形成化合物F,其晶胞结构如图所示,晶胞参数a=0.566 nm,F的化学式为________;晶体F的密度(g·cm-3 )________________________________。(列出表达式)
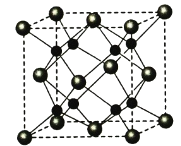
-
A、B、C、D为原子序数依次增大的四种元索,A2-和B+具有相同的电子构型;C、D为同周期元素,C核外电子总数是最外层电子数的3倍;D元素最外层有一个未成对电子。回答下列问题:
(1)四种元素中电负性最大的是 (填元素符号),其中C原子的核外电子排布布式为__________。
(2)单质A有两种同素异形体,其中沸点高的是 (填分子式),原因是 ;A和B的氢化物所属的晶体类型分别为 和 。
(3)C和D反应可生成组成比为1:3的化合物E,E的立体构型为 ,中心原子的杂化轨道类型为 。
(4)化合物D2A的立体构型为 ,中心原子的价层电子对数为 ,单质D与湿润的Na2CO3反应可制备D2A,其化学方程式为 。
(5)A和B能够形成化合物F,其晶胞结构如图所示,晶胞参数,边长a= 0.566nm, F 的化学式为 :晶胞中A 原子的配位数为 ;列式计算晶体F的密度(g·cm-3) 。