-
下列关于价层电子对互斥模型(VSEPR 模型)的叙述中不正确的是( )
A.VSEPR 模型可用来预测分子的立体构型
B.分子中价电子对相互排斥决定了分子的立体构型
C.中心原子上的孤对电子也要占据中心原子周围的空间并参与互相排斥
D.分子中键角越大,价电子对相互排斥力越大,分子越稳定
难度: 简单查看答案及解析
-
下列说法正确的是( )
A.干冰升华和液氯气化时要破坏不同的微粒间作用力
B.CO2和SiO2具有相同的化学键类型和晶体类型
C.水结成冰体积膨胀、密度变小,这一事实与水中存在氢键有关
D.盐酸能电离出氢离子和氯离子,所以HCl存在离子键
难度: 中等查看答案及解析
-
基态原子的核外电子排布式为[Kr]4d105s1 的元素在元素周期表中的位置是
A.p 区、第五周期第ⅠB 族 B.ds 区、第五周期第Ⅷ族
C.d 区、第四周期第ⅠB 族 D.ds 区、第五周期第ⅠB 族
难度: 简单查看答案及解析
-
下列关于电离能和电负性的说法不正确的是( )
A.第一电离能:Mg>Al
B.硅的第一电离能和电负性均大于磷
C.锗的第一电离能和电负性均小于碳
D.F、K、Fe、Ni四种元素中电负性最大的是F
难度: 中等查看答案及解析
-
下列关于[Cr(H2O)4Br2]Br·2H2O]的说法正确的是( )
A.配体为水分子,外界为Br-
B.Br-均为配体
C.中心离子的配位数为6
D.中心离子的化合价为+2
难度: 简单查看答案及解析
-
下列关于杂化轨道的叙述正确的是( )
A. 杂化轨道可用于形成σ键,也可用于形成π键
B. 杂化轨道可用来容纳未参与成键的孤电子对
C. NH3中N原子的sp3杂化轨道是由N原子的3个p轨道与H原子的s轨道杂化而成的
D. 在乙烯分子中,1个碳原子的3个sp2杂化轨道与3个氢原子的s轨道重叠形成3个C—H σ键
难度: 简单查看答案及解析
-
已知含氧酸可用通式(OH)nXOm来表示,如X是S,则m=2,n=2,则这个式子就表示H2SO4。一般而言,该式中m大的是强酸,m小的是弱酸。下列各含氧酸中酸性最强的是( )
A.H2SeO3 B.HMnO4 C.H3BO3 D.H3PO4
难度: 简单查看答案及解析
-
有5种元素X、Y、Z、Q、T。X原子M层上有2个未成对电子且无空轨道;Y原子的特征电子构型为3d64s2;Z原子的L电子层的p能级上有一个空轨道;Q原子的L电子层的P能级上只有一对成对电子;T原子的M电子层上p轨道半充满。下列叙述不正确的是( )
A.X和Q结合生成的化合物为离子化合物
B.T和Z各有一种单质的空间构型为正四面体形
C.元素Y和Q可形成化合物Y2O3
D.ZO2是极性键构成的非极性分子
难度: 困难查看答案及解析
-
下列化学用语表示正确的是( )
A.Fe原子的电子排布式:[Ar]3d54s3
B.CaCl2的电子式:
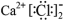
C.N2的结构式:N-N
D.原子核内有10个中子的氧原子:
 O
O难度: 简单查看答案及解析
-
北京“鸟巢”运用了高强度、高性能的钒氮合金高新钢,钒元素的原子序数为23,则钒原子的外围电子排布式正确的是( )
A.3s23p6 B.3d34s2
C.3d64s2 D.4s2
难度: 简单查看答案及解析
-
第3周期某元素的原子,其最外层3p轨道上有一个未成对电子,则关于该元素的描述正确的是( )
A.该元素最高价氧化物的水化物肯定是一种强酸
B.该元素单质可能是一种黄绿色的气体
C.该元素最高价氧化物的水化物肯定是一种强碱,只能与酸反应
D.该元素的原子半径在同周期中肯定是最小的
 稀有气体元素除外
稀有气体元素除外
难度: 简单查看答案及解析
-
科学研究证明:核外电子的能量不仅与电子所处的电子层、能级有关,还与核外电子的数目及核电荷数有关。氩原子与硫离子的核外电子排布相同,都是
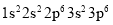 。下列说法正确的是( )
。下列说法正确的是( )A.两粒子的1s能级上电子的能量相同
B.两粒子的3p能级上的电子离核的距离相同
C.两粒子的电子发生跃迁时,产生的光谱不同
D.两粒子最外层都达8电子稳定结构,化学性质相同
难度: 简单查看答案及解析
-
下列叙述不正确的是( )
A.卤化氢分子中,卤素的非金属性越强,共价键的极性越强,稳定性也越强
B.以极性键结合的分子,不一定是极性分子
C.判断A2B或AB2型分子是极性分子的依据是:具有极性键且分子构型不对称,键角小于180°,为非直线形结构
D.非极性分子中,各原子间都应以非极性键结合
难度: 中等查看答案及解析
-
N2的结构可以表示为
 ,CO的结构可以表示为
,CO的结构可以表示为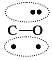 ,其中椭圆框表示 π键,下列说法不正确的是( )
,其中椭圆框表示 π键,下列说法不正确的是( )A.N2 分子与 CO 分子中都含有三键
B.CO 分子中有一个 π 键是配位键
C.N2 与 CO 互为等电子体
D.N2 与 CO 的化学性质相同
难度: 简单查看答案及解析
-
甲醛分子结构式如图,用2个Cl取代甲醛中的H可得到碳酰氯,下列描述正确的是( )

A.甲醛分子和碳酰氯分子是等电子体
B.碳酰氯分子中的C原子为手性碳原子
C.甲醛分子中的H-C-H键角与碳酰氯分子中的Cl-C-Cl相等
D.碳酰氯分子为平面三角形,分子中存在有3个σ键、1个π键
难度: 简单查看答案及解析
-
向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续添加氨水,难溶物溶解得到深色的透明溶液。下列对此现象说法正确的是( )
A.反应后溶液中不存在任何沉淀,所以反应前后Cu2+的浓度不变
B.沉淀溶解后,将生成深蓝色的配离子[Cu(NH3)4] 2+
C.向反应后的溶液加入乙醇,溶液没有发生变化
D.在[Cu(NH3)4] 2+离子中,Cu2+给出孤对电子,NH3提供空轨道
难度: 简单查看答案及解析
-
下列判断与分子间作用力无关的是( )
A.熔点:H2O>H2S B.NH3易液化
C.CH3CH2OH易溶于水 D.HI易分解
难度: 简单查看答案及解析
-
下列化合物中含有手性碳原子的是
A.CCl2F2 B.
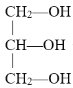 C.CH3CH2OH D.
C.CH3CH2OH D.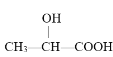
难度: 简单查看答案及解析
-
关于晶体的下列说法中正确的是
A.溶质从溶液中析出是得到晶体的三条途径之一
B.区别晶体和非晶体最好的方法是观察是否有规则的几何外形
C.水晶在不同方向上的硬度、导热性、导电性相同
D.只有无色透明的固体才是晶体
难度: 简单查看答案及解析
-
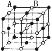
现在四种晶体,其离子排列方式如图所示,其中化学式正确的是( )
A.AB2
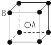
B.EF2
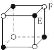
C.XY3Z
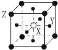
D.AB3
难度: 简单查看答案及解析
-
丁二酮肟镍是丁二酮肟在氨性溶液(pH=8~9)中与Ni2+发生反应生成的沉淀,该反应常用作实验室中检验镍离子。其结构如图所示,下列对该物质的分析与判断中,正确的是
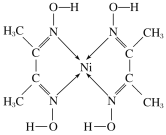
A.该物质中Ni原子具有空轨道,是配合物的配体
B.该物质中C、N、O原子存在孤电子对
C.该物质的分子中含有的化学键有共价键和配位键
D.该物质中碳原子的杂化类型均为sp2杂化
难度: 中等查看答案及解析
-
Co3+的八面体配合物CoClm·nNH3中配离子的空间构型如图所示,其中数字处的小圆圈表示NH3分子或Cl-,Co3+位于八面体的中心。若1mol配合物与AgNO3作用生成2molAgCl沉淀,则n的值是
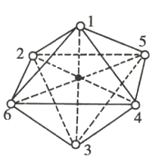
A.2 B.3 C.4 D.5
难度: 简单查看答案及解析
-
科学家最近发现一种由钛原子和碳原子构成的气态团簇分子,结构如图所示,则其化学式可表示为( )
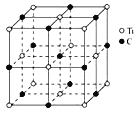
A.Ti14C13 B.Ti4C4 C.TiC D.Ti14C12
难度: 简单查看答案及解析
-
中美学者携手发现了全硼富勒烯团簇—B40。B40团簇的结构,酷似中国的红灯笼(如图)。该材料可用于组装分子器件,在储氢储锂、半导体、超导、绿色催化等领域具有重要应用前景。下列有关说法正确的是( )
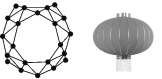
A.B40与石墨烯的结构相同,二者互为同素异形体
B.43.2g该物质含有2.408×1024个原子
C.B40中既含有极性键又含有非极性键
D.全硼富勒烯团簇是一种新型的高分子材料
难度: 简单查看答案及解析
-
下列关于物质结构的命题中,错误的项数有
①CH3COOH分子中碳原子的杂化类型有sp2和sp3两种
②元素Ge位于周期表第四周期IVA族,核外电子排布式为[Ar]4s24p2,属于P区
③非极性分子往往具有高度对称性,如BF3、H2O2、CO2这样的分子
④冰中存在极性共价键和氢键两种化学键的作用
⑤Cu(OH)2是一种蓝色絮状沉淀,既溶于硝酸、氨水,也能溶于硫酸氢钠溶液中
⑥熔融态的HgCl2不导电,HgCl2稀溶液有弱的导电能力说明固态HgCl2是共价化合物,为非电解质
⑦氨水中大部分NH3与H2O以氢键(用“...”表示)结合成NH3·H2O分子,根据氨水的性质可知NH3.H2O的结构式可记为:
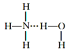
A.4项 B.5项 C.6项 D.7项
难度: 简单查看答案及解析
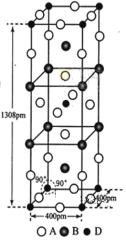
 同周期,Te属于元素周期表中__区元素,其基态原子的价电子排布图(即轨道表示式)为___。
同周期,Te属于元素周期表中__区元素,其基态原子的价电子排布图(即轨道表示式)为___。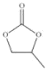 ,则其中π键和σ键的数目之比为___,碳原子的杂化轨道类型为____。
,则其中π键和σ键的数目之比为___,碳原子的杂化轨道类型为____。