-
化学在人类社会发展中发挥着重要作用,下列事实不涉及化学反应的是( )
A.利用废弃的秸秆生产生物质燃料乙醇
B.利用石油生产塑料、化纤等高分子材料
C.利用基本的化学原料生产化学合成药物
D.利用反渗透膜从海水中分离出淡水
难度: 简单查看答案及解析
-
用下列实验装置进行相应实验,能达到实验目的的是
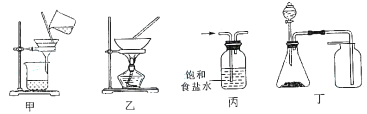
A.用装置甲过滤海带灰的浸泡液以获得含I-的溶液
B.用装置乙蒸干氯化铵饱和溶液制备NH4Cl晶体
C.用装置丙将Cl2与HCl混合气体纯化得到纯净的Cl2
D.用装置丁收集铜粉与稀硝酸反应产生的NO
难度: 中等查看答案及解析
-
在“新冠肺炎战疫”中,大量防护和消毒用品投入使用。其中熔喷布是一次性医用口罩的重要材料,熔喷布以聚丙烯为主要原料,其纤维直径可以达到1~5微米,这些具有独特的毛细结构的超细纤维增加单位面积纤维的数量和表面积,从而使熔喷布具有很好的过滤性、屏蔽性、绝热性和吸油性,可用于空气、液体过滤材料、隔离材料、吸纳材料、口罩材料、保暖材料及擦拭布等领域。下列说法错误的是( )
A.84消毒液和医用酒精杀灭病毒的原理不同
B.疫情期间用过的口罩要投放到专用的垃圾收集箱,最后由专门单位集中进行无害化处理
C.聚丙烯的单体CH3—CH=CH2分子中最多有7个原子共平面
D.聚乙烯和聚丙烯互为同系物
难度: 中等查看答案及解析
-
能正确解释下列反应原理,并且其离子方程式书写正确的是( )
A.泡沫灭火器中Al2(SO4)3和NaHCO3溶液混合:Al3++3HCO
 =Al(OH)3↓+3CO2↑
=Al(OH)3↓+3CO2↑B.用小苏打治疗胃酸过多:CO
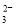 +2H+=CO2↑+H2O
+2H+=CO2↑+H2OC.电解MgCl2饱和溶液制取Mg:MgCl2
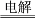 Mg+Cl2↑
Mg+Cl2↑D.用明矾作净水剂:Al3++3H2O=Al(OH)3↓+3H+
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值。下列叙述中不正确的是( )
A.标准状况下,22.4LC3H6分子中含有NA个碳碳双键
B.常温下,46g的NO2和N2O4混合气体中含有的氮原子数为NA
C.常温常压下,0.1mol的Na2O和Na2O2,混合物中阴离子总数为0.1NA
D.100mL0.1mol·L−1CH3COONa溶液中阴离子总数大于0.01NA
难度: 中等查看答案及解析
-
锂—铜空气电池是低成本高效电池。该电池通过一种复杂的铜“腐蚀”现象产生电能,其中放电过程为2Li+Cu2O+H2O=2Cu+2Li++2OH-。下列说法不正确的是( )
A.放电时,Li+透过固体电解质向Cu极移动
B.通空气时,铜被腐蚀产生Cu2O
C.放电时,正极的电极反应式为Cu2O+2H++2e-=2Cu+H2O
D.整个反应过程中,氧化剂为O2
难度: 中等查看答案及解析
-
下列各组中的反应,属于同一反应类型的是
A.由溴丙烷水解制丙醇;由丙烯与水反应制丙醇
B.由甲苯硝化制对硝基甲苯;由甲苯氧化制苯甲酸
C.由氯代环己烷消去制环己烯;由丙烯加溴制
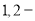 二溴丙烷
二溴丙烷D.由乙酸和乙醇制乙酸乙酯;由苯甲酸乙酯水解制苯甲酸和乙醇
难度: 简单查看答案及解析
-
下列说法正确的是( )
A.14C与12C60互为同位素
B.14C60与12C60是具有相同质子数的不同核素
C.CH3COOH与HCOOCH3互为同素异形体
D.硝基苯与
 互为同分异构体
互为同分异构体难度: 简单查看答案及解析
-
环戊二烯(
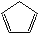 )容易发生聚合生成二聚体,该反应为可逆反应。不同温度下,溶液中环戊二烯浓度与反应时间的关系如图所示,下列说法正确的是( )
)容易发生聚合生成二聚体,该反应为可逆反应。不同温度下,溶液中环戊二烯浓度与反应时间的关系如图所示,下列说法正确的是( )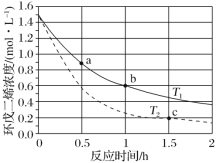
A.T1>T2
B.b点时二聚体的浓度为0.45mol·L-1
C.a点的正反应速率小于b点的逆反应速率
D.a点的反应速率小于c点的反应速率
难度: 中等查看答案及解析
-
韶关特产清化粉的生产可追溯到唐朝(685年—716年),已有1300多年历史。选用直链淀粉含量达17%至26%的籼稻米,经以下工艺加工而成:原料→精选→清洗→浸泡→磨浆→一次蒸粉→晾干→二次煮制→切粉→成型→干燥→包装→检验→成品,下列有关选项正确的是( )
A.以上制作工艺中用到了研磨、过滤、蒸馏、干燥等基本操作
B.以上直链淀粉不是天然高分子化合物
C.工艺中的“清洗”目的是去除灰尘、泥土和漂浮物等杂质
D.为了延长保质期,可往米粉中加入适量的福尔马林
难度: 中等查看答案及解析
-
化合物
 (甲)、
(甲)、 (乙)、
(乙)、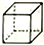 (丙)的分子式均为C8H8,下列说法正确的是
(丙)的分子式均为C8H8,下列说法正确的是A. 甲的同分异构体只有乙和丙两种 B. 甲、乙、丙均可与溴的四氯化碳溶液反应
C. 甲、乙、丙的二氯代物种数最少的是丙 D. 甲中所有原子一定处于同一平面
难度: 中等查看答案及解析
-
短周期元素W、X、Y、Z的原子序数依次递增,a、b、c、d、e、f是由这些元素组成的化合物,a的一种重要用途为清洁能源,d是淡黄色粉末,m为元素Y的单质,通常为无色无味的气体。上述物质的转化关系如图所示。下列说法错误的是( )
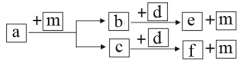
A.简单离子半径:Z<Y
B.阴离子的还原性:Y>W
C.简单气态氢化物的热稳定性:Y>X
D.W2Y2中含有非极性键
难度: 中等查看答案及解析
-
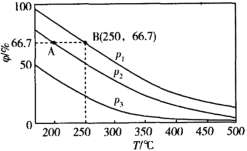
绚丽多彩的无机颜料的应用曾创造了古代绘画和彩陶的辉煌。硫化镉(CdS)是一种难溶于水的黄色颜料,在水中存在沉淀溶解平衡:CdS(s)
 Cd2+(aq)+S2-(aq),其溶度积Ksp=c(Cd2+)·c(S2-),其在水中的沉淀溶解平衡曲线如图所示(T2>T1)。下列说法错误的是( )
Cd2+(aq)+S2-(aq),其溶度积Ksp=c(Cd2+)·c(S2-),其在水中的沉淀溶解平衡曲线如图所示(T2>T1)。下列说法错误的是( )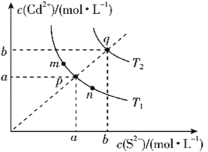
A.T1时CdS在c(S2-)=0.01mol/L的Na2S溶液中,c(Cd2+)=100a2mol/L
B.图中各点对应的Ksp的关系为:Ksp(m)=Ksp(n)<Ksp(p)<Ksp(q)
C.向m点的溶液中加入少量Na2S固体,溶液组成由m沿mpn线向p方向移动
D.温度降低时,q点的饱和溶液的组成由q沿qp线向p方向移动
难度: 困难查看答案及解析
-
下列实验操作、现象和结论均正确的是( )
选项
实验操作
实验现象
结论
A
将某有机物与溴的四氯化碳溶液混合
溶液褪色
该有机物中必定含有碳碳双键
B
向亚硫酸钠溶液中滴加硝酸钡和稀硝酸
产生白色沉淀
亚硫酸钠溶液已变质
C
向酸性高锰酸钾溶液中滴加双氧水
紫色褪去,产生气泡
H2O2具有还原性
D
向乙醇溶液中加一小块钠
产生气泡
乙醇含有羟基
A.A B.B C.C D.D
难度: 中等查看答案及解析

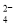 +H2O,该反应是经历以下两步反应实现的:ⅰ:Fe2O3+6H+=2Fe3++3H2O;ⅱ:……。写出ⅱ的离子方程式___。
+H2O,该反应是经历以下两步反应实现的:ⅰ:Fe2O3+6H+=2Fe3++3H2O;ⅱ:……。写出ⅱ的离子方程式___。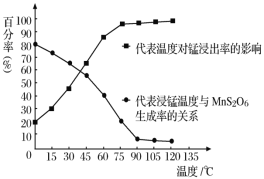
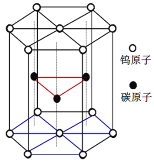
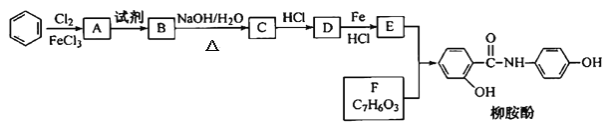
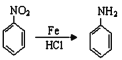
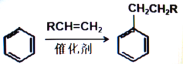 (R为烃基或H原子)
(R为烃基或H原子) CH3COOH
CH3COOH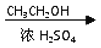 CH3COOCH2CH3
CH3COOCH2CH3 CO(g)+3H2(g) ΔH1=+205.9kJ·mol-1①
CO(g)+3H2(g) ΔH1=+205.9kJ·mol-1①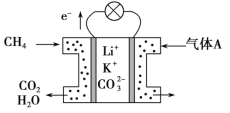
 2NH3(g)
2NH3(g)