-
在相同温度下,100 mL 0.01mol/L醋酸溶液与10 mL 0.1mol/L醋酸溶液相比,下列数值前者大于后者的是( )
A. 完全中和时所需NaOH的物质的量 B. CH3COOH的电离程度
C. H+的物质的量浓度 D. CH3COOH的物质的量
难度: 中等查看答案及解析
-
炒菜时,加入一些料酒和食醋可使菜变得味香可口,其中的原因是
A.有盐类物质生成
B.有酯类物质生成
C.有醇类物质生成
D.有酸类物质生成
难度: 中等查看答案及解析
-
下列对甲烷、乙烯性质的描述中,不正确的是( )
A.乙烯能使溴水褪色
B.在一定条件下,乙烯自身加聚生成聚乙烯
C.甲烷能使酸性高锰酸钾溶液褪色
D.在光照条件下,甲烷与氯气发生取代反应
难度: 简单查看答案及解析
-
下列有关苯的叙述中,错误的是( )
A.能使酸性KMnO4溶液褪色
B.无色、有特殊气味的液体,不溶于水,密度比水的小
C.在FeBr3催化作用下,苯与液溴反应生成溴苯和溴化氢
D.50~60℃时,在浓硫酸存在下,苯与浓硝酸反应生成硝基苯和水
难度: 简单查看答案及解析
-
下列关于乙醇、乙酸的说法中,不正确的是( )
A.乙醇、乙酸均易溶于水
B.乙醇能与金属钠反应
C.乙醇使酸性KMnO4溶液褪色
D.乙酸的酸性比碳酸弱
难度: 简单查看答案及解析
-
将Cu、Zn、电流计用导线连接后浸入稀硫酸组成如图装置。下列说法不正确的是( )
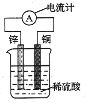
A.装置中存在“化学能→电能”的转化
B.铜片是正极,铜片上产生气泡
C.锌片是负极,其质量逐渐减小
D.如果将锌片换成铜片,电流计指针会发生偏转
难度: 中等查看答案及解析
-
下列物质水解的化学方程式中,书写不正确的是( )
A.NH4Cl + H2O
NH3·H2O + HCl
B.Na2S + 2H2O
H2S + 2NaOH
C.CH3COONa + H2O
CH3COOH + NaOH
D.AlCl3 + 3H2O
Al(OH)3 + 3HCl
难度: 简单查看答案及解析
-
可逆反应A(g)+3B(g)
2C(g)+2D(g),在四种不同的情况下的反应速率分别为:
①υ(A)=0.15 mol/(L·s) ②υ(B)=0.6 mol/(L·s),
③υ(C)=0.30mol/(L·s) ④υ(D)=0.2 mol/(L·s)。该反应进行最快的是
A.① B.② C.③ D.④
难度: 简单查看答案及解析
-
相同物质的量浓度的下列溶液中,pH值最大的是( )
A.碳酸钠溶液 B.碳酸氢钠溶液 C.食盐水 D.硫酸铜溶液
难度: 中等查看答案及解析
-
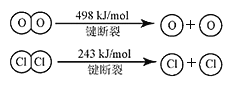
下列热化学方程式中△H表示可燃物燃烧热的是
A.C(s) + 1/2 O2(g) = CO(g) △H= -110.5 kJ/mol
B.2H2(g) + O2(g) = 2H2O(l) △H= -571.6kJ/mol
C.CH4(g) + 2O2(g) = CO2(g) + 2H2O(g) △H=-802.3kJ/mol
D.CO(g) + 1/2 O2(g) = CO2(g) △H= -283.0kJ/mol
难度: 简单查看答案及解析
-
已知:△G=△H-T△S,当△G<0,反应能自发进行,△G>0反应不能自发进行。生产合成气的反应:C(s) + H2O(g)=CO(g) + H2(g)在高温时才能自发进行。下列对该反应过程的ΔH、ΔS判断正确的是( )
A.ΔH>0,ΔS<0 B.ΔH<0,ΔS<0 C.ΔH>0,ΔS>0 D.ΔH<0,ΔS>0
难度: 简单查看答案及解析
-
已知:25℃、101 kPa条件下,① 4Al(s)+ 3O2(g)=2Al2O3(s) ΔH=-2834.9 kJ/mol;②4Al(s) + 2O3(g) =2Al2O3(s) ΔH=-3119.1 kJ/mol。由此得出的正确结论是( )
A.等质量的O2比O3能量低,由O2变O3为放热反应
B.等质量的O2比O3能量高,由O2变O3为吸热反应
C.O3比O2稳定,由O2变O3为放热反应
D.O2比O3稳定,由O2变O3为吸热反应
难度: 中等查看答案及解析
-
在一密闭容器中的一定量混合气体发生反应:xA(g) + yB(g)
zZ(g)平衡时测得A的浓度为0.50mol/L,保持温度不变,将容器的容积扩大到原来的两倍,再达到平衡时,A的浓度为0.30mol/L。下列有关判断正确的是( )
A.x + y < z B.平衡向正反应方向移动
C.物质B的转化率降低 D.物质Z的体积分数增大
难度: 中等查看答案及解析
-
25℃,将100mL0.14 mol/LNaOH溶液与100mL0.06 mol/L硫酸溶液混合,所得200mL混合溶液的pH为( )
A.12 B.12.3 C.13 D.14
难度: 中等查看答案及解析
-
科学家利用X射线激光技术观察到CO与O在催化剂表面形成化学键的过程。反应过程及能量变化如图。下列说法中不正确的是( )
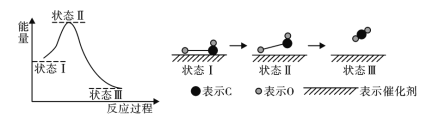
A.状态Ⅰ到状态Ⅱ时一个吸热过程
B.状态Ⅰ的总能量大于状态Ⅲ的总能量
C.状态Ⅱ→状态Ⅲ是旧化学键断裂的过程
D.在该过程中,CO分子中碳氧键没有断裂成C和O
难度: 中等查看答案及解析
-
将打磨后的镁条放入盛有50mL蒸馏水的烧杯中,用pH传感器和浊度传感器监测溶液中pH和溶液浊度随时间的变化如图.下列有关描述正确的( )
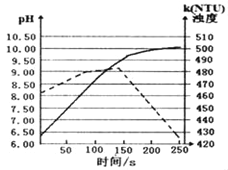
A. 实线表示溶液浊度随时间的变化
B. 50s时向溶液中滴入酚酞试液,溶液变红
C. 该实验是在常温下进行的
D. 150s后溶液浊度下降是因为生成的Mg(OH)2沉降
难度: 困难查看答案及解析
-
现有HA、HB两种酸。25℃时,用0.1000mol/LNaOH溶液分别滴定20.00mL浓度均为0.1000mol/L的HA、HB两种酸的溶液,滴定过程中溶液的pH随滴入的NaOH溶液体积的变化如图。下列说法正确的是( )
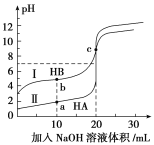
A.b 点对应的溶液中c(B-)> c(HB)
B.用NaOH溶液滴定HB溶液时适宜用甲基橙指示剂
C.曲线Ⅰ上的c点溶液中:c(B-) > c(Na+) >c(OH-)>c(H+)
D.中和等体积、等浓度的HB和HA,所需NaOH:HA>HB
难度: 中等查看答案及解析
-
t℃时,将0.200mol/L的某一元酸HA与0.200mol/L的NaOH溶液等体积混合,所得混合溶液中部分离子浓度如下表。
微粒
H+
Na+
A-
浓度(mol/L)
2.50×10-10
0.100
9.92×10-2
下列说法中正确的是
A.所得溶液中: c(Na+) >c(A-) >c(HA) >c(OH-)
B.t℃时,水的离子积Kw < 1.0×10-14
C.t℃时,一元酸HA的电离常数K=3.10×10-8
D.t℃时,0.100mol/LNaA溶液中A-的水解率为0.400%
难度: 困难查看答案及解析
-
将等物质的量的A、B两种气体混合于2L的密闭容器中,发生如下反应:3A(g) + B(g)
x C(g) + 2D(g)。经4min达到化学平衡。此时测得D的浓度为0.05mol/L,且c(A)∶c(B) = 3∶5,C的平均速率为0.0125 mol/(L∙min)。下列说法不正确的是( )
A.x的值为2
B.C的体积分数为20%
C.起始时容器中A的物质的量浓度为0.15 mol/L
D.0~ 4min用 B表示的平均速率为6.25×10-3 mol/(L∙min)
难度: 中等查看答案及解析
-
一定温度下,在3个容积均为1.0 L的恒容密闭容器中发生反应:PCl5(g)
PCl3(g)+ Cl2(g)。
容器编号
物质的起始浓度(mol/L)
物质的平衡浓度(mol/L)
c(PCl5)
c(PCl3)
c(Cl2)
c(Cl2)
Ⅰ
0.4
0
0
0.2
Ⅱ
1.05
0.05
1.95
Ⅲ
0.8
0
0
下列说法正确的是( )
A.达平衡时,容器Ⅰ与容器Ⅱ中的总压强之比为 6∶31
B.达平衡时,容器Ⅰ中
比容器Ⅱ中的大
C.达平衡时,容器Ⅲ中Cl2的体积分数大于
D.达平衡时,容器Ⅲ中0.2 mol/L<c(PCl5)<0.4mol/L
难度: 中等查看答案及解析