-
下列说法正确的是( )
A. 反应物分子的每次碰撞都能发生化学反应
B. 活化分子之间的碰撞一定是有效碰撞
C. 能够发生化学反应的碰撞是有效碰撞
D. 增大反应物浓度时,活化分子百分数增大
难度: 中等查看答案及解析
-
物质的量浓度相同的下列溶液中,符合按pH由小到大顺序排列的是
A.Na2CO3 NaHCO3 NaCl NH4Cl
B.Na2CO3 NaHCO3 NH4Cl NaCl
C.(NH4)2SO4 NH4Cl NaNO3 Na2S
D.NH4Cl (NH4)2SO4 Na2S NaNO3
难度: 中等查看答案及解析
-
纯净的水呈中性,这是因为( )
A.纯水中c(H+)= c(OH-) B.纯水pH=7
C.纯水的离子积Kw=1.0×10-14 D.纯水中无H+也无OH-
难度: 中等查看答案及解析
-
已知下列热化学方程式:
(1)CH3COOH(l)+2O2(g)= 2CO2(g)+2H2O(l) ΔH1=-870.3 kJ/mol
(2)C(s)+O2(g)= CO2(g) ΔH2=-393.5 kJ/mol
(3)H2(g)+
O2(g)= H2O(l) ΔH3=-285.8 kJ/mol
则反应2C(s)+2H2(g)+O2(g)= CH3COOH(l)的焓变为( ).
A.-488.3 kJ/mol B.-244.15 kJ/mol C.488.3 kJ/mol D.244.15 kJ/mol
难度: 中等查看答案及解析
-
容积固定为3L的某密闭容器中加入1molA、2molB,一定温度下发生如下反应:A(s)+2B(g)
C(g)+D(g),经反应5min后,测得C的浓度为0.3mol/L。下列说法中正确的是( )
A.5min内D的平均反应速率为0.02mol·(L·min)-1
B.5min内B的平均反应速率为0.12mol·(L·min)-1
C.经5min后,向容器内再加入C,正反应速率变小
D.生成1molD的同时生成1molC一定是平衡状态
难度: 简单查看答案及解析
-
在密闭容器中,一定量混合气体发生下列反应: aM(g)+ bN(g)
cW(g),达一平衡后,测得M气体的浓度为0.5mol/L。当在恒温下,将密闭容器的体积扩大1倍,再达平衡时,测得M气体的浓度为0.3mol/L。则下列叙述正确的是 ( )
A.反应速率增大 B.W的体积分数降低
C.N的转化率提高 D.平衡向右移动
难度: 中等查看答案及解析
-
常温下,某溶液中由水电离产生的c(H+)=1×10-12mol/L,在该溶液中一定能大量共存的离子组是( )
A.K+ 、Na+ 、HSO3-、Cl- B.Na+、Ba2+、 NO3- 、Cl-
C.K+ 、S2-、Cl- 、CO32- D.K+ 、NH4+ 、Cl- 、SO42-
难度: 中等查看答案及解析
-
从下列事实,找出不能用勒夏特列原理解释的是 ( )
A.在溴水中存在如下平衡:Br2+H2O
HBr+HBrO,当加入NaOH溶液后颜色变浅
B.反应CO+NO2
CO2+NO △ H<0,升高温度使平衡向逆方向移动
C.对2HI
H2+I2
平衡体系增加压强使颜色变深
D.合成氨反应:N2+3H2
2NH3 △H<0,为使氨的产率提高,理论上应采取低温
难度: 中等查看答案及解析
-
在密闭容器中进行下列反应:M(g)+N(g)
R(g)+2L此反应符合下列图象(R%为R在平衡混合物中的体积分数),则该反应是( )
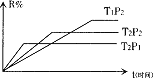
A.正反应是吸热反应,L是气体
B.正反应是放热反应,L是气体
C.正反应是吸热反应,L是固体
D.正反应是放热反应,L是固体或液体
难度: 简单查看答案及解析
-
250 ℃和1.01×105Pa时,反应 2N2O5(g)=4NO2(g)+O2(g) △H=+56.76 kJ/mol,自发进行的原因是( )
A.是吸热反应 B.是放热反应
C.是熵减少的反应 D.熵增大效应大于焓增大的效应
难度: 简单查看答案及解析
-
在一定温度下容积不变的容器中能说明反应:C(s) + H2O(g)
CO(g)+H2(g)达到化学平衡状态的是( )
①气体的压强不变 ②每生成n个CO分子同时生成n个H2分子 ③四种物质的分子数之比为1:1:1:1 ④气体的密度不变⑤断裂2n个H-O键同时断裂n个H-H键⑥气体的平均摩尔质量不变
A.①⑤⑥ B.②⑤⑥ C.①④⑤⑥ D.①②④⑤⑥
难度: 中等查看答案及解析
-
pH值相等的盐酸(甲)和醋酸(乙),分别与锌反应,若最后锌已全部溶解且放出气体一样多,为此下列说法正确的是( )
A.反应开始时的速率:甲>乙 B.反应所需时间:甲<乙
C.反应开始时,酸的物质的量浓度:甲<乙 D.反应结束时,pH值:甲<乙
难度: 中等查看答案及解析
-
实验:①0.1mol·L-1AgNO3溶液和0.1mol·L-1NaCl溶液等体积混合得到浊液a,过滤得到滤液b和白色沉淀c;② 向滤液b中滴加0.1mol·L-1KI溶液,出现浑浊;③ 向沉淀c中滴加0.1mol·L-1KI溶液,沉淀变为黄色。下列分析不正确的是
A.浊液a中存在沉淀溶解平衡:AgCl(s)
Ag+(aq)+ Cl-(aq)
B.滤液b中不含有Ag+
C.③中颜色变化说明AgCl 转化为AgI
D.实验可以证明AgI比AgCI更难溶
难度: 中等查看答案及解析
-
在Na2S溶液中下列关系不正确的是
A.c(Na+) =2c(HS-) +2c(S2-) +2c(H2S)
B.c(Na+) +c(H+)=c(OH-)+c(HS-)+ 2c(S2-)
C.c(Na+) > c(S2-) >c(OH-)>c(HS-)
D.c(OH-)=c(HS-)+c(H+)+ c(H2S)
难度: 简单查看答案及解析
-
接触法制硫酸工艺中,其主反应在450℃并有催化剂存在下进行:2SO2(g) + O2(g)
2SO3(g)
H=-197 kJ/mol。下列说法正确的是
A.使用催化剂可以提高该反应的焓变
B.增大O2的浓度可以提高反应速率和SO2的转化率
C.反应450℃时的平衡常数小于500℃时的平衡常数
D.2 mol SO2(g) 和1 mol O2(g)所含的总能量小于2 mol SO3(g) 所含的总能量
难度: 中等查看答案及解析
-
常温下,0.2mol•L-1的一元酸HCl与等浓度的MOH溶液等体积混合后,所得溶液中部分微粒组成及浓度如图所示,下列说法正确的是( )
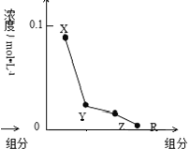
A.MOH的电离方程式:MOH=M++OH-
B.该混合液中水电离出来的c(H+)<10-7mol/L
C.该混合液中:c(R)+c(X)=c(Y)+c(Z)
D.图中c(X)+c(Z)=0.1mol/L
难度: 中等查看答案及解析
 b
b  c
c  d
d 