-
下列物质分类或归纳正确的是( )
①化合物:CaCl2、NaOH、C60、HBr
②有机物:C6H12O6、CH3COOH、(C6H10O5)n、C3H8
③混合物:盐酸、漂白粉、水银、空气
④同素异形体:金刚石与C60、红磷与白磷
⑤放热反应:中和反应、镁与稀硫酸的反应、铁生锈
⑥酸性氧化物:P2O5、CO2、CO、SO3
A.①③④
B.①②③④
C.②④⑤
D.①②④⑥
难度: 中等查看答案及解析
-
钢笔的笔头是合金钢,其笔头尖端是用机器轧出的便于使用的圆珠体。为了改变笔头的耐磨性能,在笔头尖端点上铱金粒,为区别钢笔而叫铱金笔。下列说法中错误的是( )
A.钢笔的笔头不易被氧化,抗腐蚀性能好
B.铱金笔的耐磨性能比钢笔要好
C.铱金笔的笔头和笔尖都是用合成材料制成的
D.铱金笔经久耐磨,书写时弹性特别好,是一种理想的硬笔
难度: 简单查看答案及解析
-
碲锌镉(Te-Zn-Cd)晶体可以用于制造红外探测器的基础材料,下列有关叙述中不正确的是( )
A.它是由Te、Zn、Cd按一定比例混合而成的,无固定的熔点、沸点
B.它易导电、导热,具有延展性
C.它的熔点比Te、Zn的低
D.它的硬度和强度比Cd的大
难度: 简单查看答案及解析
-
氧化还原反应指有元素化合价发生改变(有升高和降低)的反应。重铬酸铵(NH4)2Cr2O7是一种受热易分解的盐,若是发生氧化还原反应而分解,下列各组对重铬酸铵受热分解产物的判断,可能符合事实的是( )
A.
B.
C.
D.
难度: 简单查看答案及解析
-
已知,同温、同压下,相同体积的任何气体都含有相同数目的分子。如图所示,相同状况下,分别用氯化氢和四种不同的混合气体吹出体积相等的五个气球。A、B、C、D四个气球中所含原子数与氯化氢气球中所含原子数一定相等的是( )
A.
B.
C.
D.
难度: 中等查看答案及解析
-
氧化钙和过氧化钙(CaO2)的混合物12.8g溶于足量水后,加入足量的Na2CO3溶液,溶液中的Ca2+全部转化为沉淀,过滤、干燥,得到20g CaCO3。则原12.8g混合物中钙元素与氧元素的质量之比为(已知2CaO2+2H2O===2Ca(OH)2+O2↑)( )
A. 5:2 B. 5:3 C. 5:4 D. 1:1
难度: 中等查看答案及解析
-
某些盐在溶液中结晶时,析出的晶体是结晶水合物。下表记录了t°C时向4份相同的硫酸铜溶液中加入的无水硫酸铜的质量以及析出硫酸铜晶体(CuSO4·5H2O)的质量的实验数据:
硫酸铜溶液
Ⅰ
Ⅱ
III
IV
加入的无水硫酸铜(g)
2.5
4.0
6.0
8.0
析出的硫酸铜晶体(g)
0.10
2.8
6.4
10.0
当加入4.6g无水硫酸铜时,析出硫酸铜晶体的质量为( )
A.2.56g B.3.42g
C.3.88g D.6.82g
难度: 困难查看答案及解析
-
已知氢氧化铝的沉淀能在氢氧化钠溶液中溶解。将NaOH溶液逐滴加入到用盐酸酸化的AlCl3溶液中,若用y轴表示Al(OH)3沉淀的量,x轴表示NaOH溶液的体积,下列图像正确的是( )
A.
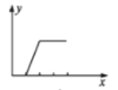 B.
B.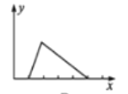
C.
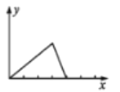 D.
D.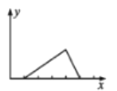
难度: 中等查看答案及解析
-
某钠盐溶液中含有Cl﹣、OH﹣、CO32﹣三种阴离子,仅用一份样品溶液,利用下面的试剂与操作就可将溶液中的三种阴离子依次检验出来,正确的实验操作顺序是( )
①滴加Mg(NO3)2溶液 ②过滤 ③滴加AgNO3溶液 ④滴加Ba(NO3)2溶液。
A.①②④②③ B.④②①②③ C.③②①②④ D.④②③②①
难度: 困难查看答案及解析
-
向一定质量的水中加入生石灰,下列曲线错误的是
A.
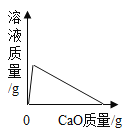 B.
B. 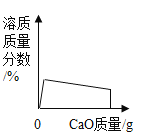 C.
C. D.
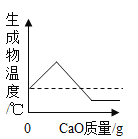
难度: 困难查看答案及解析
-
氧化铜与稀盐酸发生反应时,容器中溶液总质量随时间的变化曲线如图所示。下列说法正确的是( )
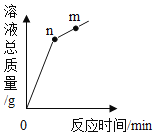
A.该实验是将氧化铜逐渐加入稀盐酸中
B.n点和m点对应溶液中铜元素质量分数相等
C.n点和m点对应溶液蒸发结晶后得到的固体成分相同
D.该曲线不能反映溶液中溶剂质量随时间的变化关系
难度: 中等查看答案及解析
-
一定温度下,硫酸铜受热分解生成
、
、
和
。已知:
、
都能被碱石灰和氢氧化钠溶液吸收。利用图装置加热硫酸铜粉末直至完全分解。硫酸铜粉末质量为10.0g,完全分解后,各装置的质量变化关系如下表所示。
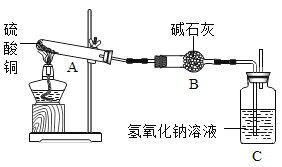
装置
A(试管+粉末)
B
C
反应前
42.0g
75.0g
140.0g
反应后
37.0g
79.5g
140.0g
请通过计算,推断出该实验条件下硫酸铜分解的化学方程式是( )
A.
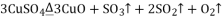
B.
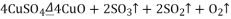
C.
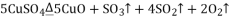
D.
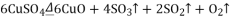
难度: 困难查看答案及解析