-
在气体反应中,能使反应物中活化分子数和活化分子百分数同时增大的方法是
①增大反应物的浓度②升高温度③增大压强④移去生成物⑤加入催化剂
A. ②⑤ B. ①②③⑤ C. ①②③ D. ①②③④⑤
难度: 简单查看答案及解析
-
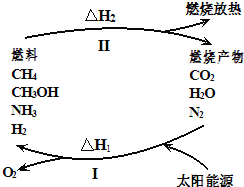
能源可划分为一级能源和二级能源,自然界以现成方式提供的能源称为一级能源;需依靠其他能源的能量间接制取的能源称为二级能源。氢气是一种高效而没有污染的二级能源,它可以由自然界中大量存在的水来制取;未来新能源的特点是资源丰富,在使用时对环境无污染或污染很小,且可以再生。下列叙述正确的是( )
A.水煤气,电能是一级能源
B.天然气,水力是二级能源
C.核能,煤,石油符合未来新能源标准
D.太阳能,生物质能,风能,氢能符合未来新能源标准
难度: 简单查看答案及解析
-
反应A+B→C分两步进行:①A+B→X,②X→C,反应过程中能量变化如图所示,E1表示反应A+B→X的活化能。下列有关叙述正确的是( )
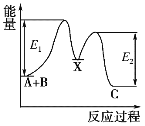
A.E2表示反应X→C的活化能
B.X是反应A+B→C的催化剂
C.反应A+B→C的ΔH<0
D.加入催化剂可改变反应A+B→C的焓变
难度: 中等查看答案及解析
-
反应物X转化为Y和Z的能量变化如图所示,下列说法正确的是

A.由X→Y反应的ΔH=E5−E2
B.由X→Z反应的ΔH>0
C.由图可知等物质的量的Y的能量一定比X的能量高
D.升高温度可提高X→Z的反应速率
难度: 中等查看答案及解析
-
在一定条件下,S8(s)和O2(g)发生反应依次转化为SO2(g)和SO3(g)。反应过程和能量关系可用如图简单表示(图中的ΔH表示生成1mol含硫产物的数据)。由图得出的结论正确的是( )
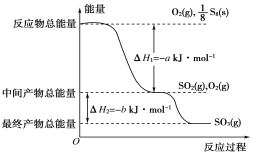
A.S8(s)的燃烧热ΔH=-8(a+b)kJ·mol-1
B.2SO3(g)
2SO2(g)+O2(g) ΔH=-2bkJ·mol-1
C.S8(s)+8O2(g)=8SO2(g) ΔH=-akJ·mol-1
D.由1molS8(s)生成SO3的反应热ΔH=-8(a+b)kJ·mol-1
难度: 中等查看答案及解析
-
下列热化学方程式书写正确的是( )
A.在101kPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)=2H2O(l) ΔH=+285.8kJ·mol-1
B.甲烷的燃烧热为△H=-890kJ·mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890kJ∙mol-1
C.500℃、30MPa下,将0.5molN2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热方程式为:N2(g)+3H2(g)
2NH3(g) △H=-38.6kJ∙mol-1
D.25℃、101kPa时,强酸与强碱的稀溶液发生中和反应的中和热为57.3kJ·mol-1,则2H+(aq)+SO
(aq)+Ba2+(aq)+2OH-(aq)=BaSO4(s)+2H2O(l) ΔH=-114.6kJ·mol-1
难度: 简单查看答案及解析
-
关于下图所示转化关系(X代表卤素)的说法不正确的是
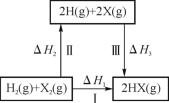
A. 2H(g)+2X(g)
2HX(g) ΔH3<0
B. 途径Ⅰ生成HX的反应热与途径无关,所以ΔH1=ΔH2+ΔH3
C. Cl、Br、I的非金属性依次减弱,所以途径Ⅱ吸收的热量依次增多
D. 途径Ⅰ生成HCl放出的热量比生成HBr的多,说明HCl比HBr稳定
难度: 中等查看答案及解析
-
通过以下反应可获得新型能源二甲醚(CH3OCH3)。下列说法不正确的是( )
①C(s)+H2O(g)=CO(g)+H2(g) ΔH1=akJ·mol-1
②CO(g)+H2O(g)=CO2(g)+H2(g) ΔH2=bkJ·mol-1
③CO2(g)+3H2(g)=CH3OH(g)+H2O(g) ΔH3=ckJ·mol-1
④2CH3OH(g)=CH3OCH3(g)+H2O(g) ΔH4=dkJ·mol-1
A.反应①、②为反应③提供原料气
B.反应③使用催化剂,ΔH3减小
C.反应CH3OH(g)=
CH3OCH3(g)+
H2O(l)的ΔH<
kJ·mol-1
D.反应2CO(g)+4H2(g)=CH3OCH3(g)+H2O(g)的ΔH=(2b+2c+d)kJ·mol-1
难度: 简单查看答案及解析
-
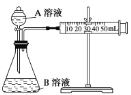
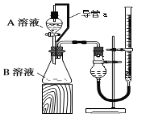
在中和热测定的实验中,以下操作正确的是:( )
①只在大烧杯底部垫泡沫塑料,使放入的小烧杯杯口与大烧杯杯口相平,再盖上硬纸板
②温度计测量过盐酸的温度后,立即插入
溶液中测量
溶液的温度
③将量筒中的
溶液慢慢加入到小烧杯的盐酸中,边加边搅拌
④读取混合溶液的最高温度和最低温度,以其平均值记为最终温度.
A.只有①正确 B.只有②正确
C.只有①④正确 D.都不正确
难度: 中等查看答案及解析
-
一定温度下,在某密闭容器中发生反应:2HI(g)
H2(g)+I2(s) ΔH>0,若0~15s内c(HI)由0.1mol·L-1降到0.07mol·L-1,则下列说法正确的是( )
A.0~15s内用I2的平均反应速率为v(I2)=0.001mol·L-1·s-1
B.c(HI)由0.07mol·L-1降到0.05mol·L-1所需的反应时间为小于10s
C.升高温度正反应速率加快,逆反应速率减慢
D.减小反应体系的体积,化学反应速率加快
难度: 简单查看答案及解析
-
反应A(g)+3B(g)=2C(g)+2D(g)在四种不同情况下的反应速率分别为:①v(A)=0.45mol/(L·s) ②v(B)=0.6mol/(L·s) ③v(C)=0.4mol/(L·s) ④v(D)=0.45mol/(L·s)。下列有关反应速率的比较中正确的是( )
A.④>③=②>① B.①>④>②=③
C.①>②>③>④ D.④>③>②>①
难度: 简单查看答案及解析
-
H2O2分解速率受多种因素影响。实验测得 70 ℃时不同条件下H2O2浓度随时间的变化如图所示。下列说法正确的是
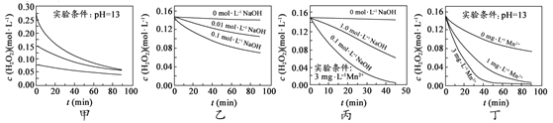
A.图甲表明,其他条件相同时,H2O2浓度越小,其分解速率越快
B.图乙表明,其他条件相同时,溶液pH越小,H2O2分解速率越快
C.图丙表明,少量Mn 2+存在时,溶液碱性越强,H2O2分解速率越快
D.图丙和图丁表明,碱性溶液中,Mn2+对H2O2分解速率的影响大
难度: 中等查看答案及解析
-
在容积为2L的密闭容器中,一定条件下发生化学反应:2NO(g)+2CO(g)
N2(g)+2CO2(g) △H= -746.4 kJ·mol-1。起始反应时 NO和CO各为 4 mol,10 秒钟后达到化学平衡,测得N2为1 mol。下列有关反应速率的说法中,正确的是( )
A. 反应前5秒钟内,用NO表示的平均反应速率为0.lmol·L-1·s-1
B. 达到平衡后,升髙温度,正反应速率将减小,逆反应速率将增大
C. 达到平衡后,反应速率的关系有:V正(CO)=2v逆(N2)
D. 保持容器体积不变,往容器中充入1 mol O2,正、逆反应速率都不改变
难度: 简单查看答案及解析
-
在一定容积的密闭容器中进行反应:N2(g)+3H2(g)
 2NH3(g)。已知反应过程中某一时刻N2、H2、NH3的浓度分别为0.1mol/L、0.3mol/L、0.2mol/L。则N2、H2、NH3的起始浓度不可能存在的数据是( )
2NH3(g)。已知反应过程中某一时刻N2、H2、NH3的浓度分别为0.1mol/L、0.3mol/L、0.2mol/L。则N2、H2、NH3的起始浓度不可能存在的数据是( )A.N2为0.2mol/L,H2为0.6mol/L
B.N2为0.15mol/L
C.N2、H2均为0.18mol/L
D.NH3为0.4mol/L
难度: 简单查看答案及解析
-
在10 L密闭容器中,1 mol A和3 mol B在一定条件下反应: A(g)+xB(g)
2C(g),2 min后反应达到平衡时,测得混合气体共3.4 mol,生成0.4 mol C,则下列计算结果正确的是
A.平衡时,物质的量之比n(A)∶n(B)∶n(C)=2∶11∶4
B.x值等于3
C.A的转化率为20%
D.B的平均反应速率为0.4 mol/(L·min)
难度: 中等查看答案及解析
-
五氧化二氮是白色固体,熔点为30℃,升温时易液化和气化,并发生以下两个相互联系的反应:①N2O5(g)
N2O3(g)+O2(g)②N2O3(g)
N2O(g)+O2(g)在0.5L密闭容器中,将2.5molN2O5加热气化,并按上述①②两式分解,在某温度下达到平衡,测得O2的平衡浓度为4.4mol/L,N2O3的平衡浓度1.6mol/L,则下列各项判断正确的是( )
A.N2O5的转化率为60%
B.平衡时N2O3的物质的量为0.7mol
C.N2O5的平衡浓度为3.0mol/L
D.N2O的平衡浓度为4.4mol/L
难度: 中等查看答案及解析