-
下列有关叙述正确的是
A. HCl和NaOH反应的中和热ΔH=-57.3 kJ·mol-1,则H2SO4和Ca(OH)2反应的中和热ΔH=2×(-57.3) kJ·mol-1
B. CO(g)的燃烧热是283.0 kJ·mol-1,则2CO2(g)=2CO(g)+O2(g)反应的ΔH=+2×283.0 kJ·mol-1
C. 2H2(g)+O2(g)=2H2O(g)ΔH<0且ΔS>0,能自发进行
D. 浓硫酸的稀释和铝热反应均为放热反应
难度: 简单查看答案及解析
-
根据以下三个热化学方程式:
2H2S(g)+3O2(g)===2SO2(g)+2H2O(l) ΔH=-Q1kJ·mol-1
2H2S(g)+O2(g)===2S(s)+2H2O(l) ΔH=-Q2kJ·mol-1
2H2S(g)+O2(g)===2S(s)+2H2O(g) ΔH=-Q3kJ·mol-1
判断Q1、Q2、Q3三者关系正确的是(
A.Q1>Q2>Q3 B.Q1>Q3>Q2 C.Q3>Q2>Q1 D.Q2>Q1>Q3
难度: 中等查看答案及解析
-
对于放热反应H2+Cl2=2HCl,下列说法中,正确的是( )
A.生成物所具有的总能量高于反应物所具有的总能量
B.反应物所具有的总能量高于生成物所具有的总能量
C.断开1 mol H-H键和1 mol Cl-Cl键所吸收的总能量大于形成2 mol H-Cl键所放出的能量
D.该反应中,化学能只转变为热能
难度: 中等查看答案及解析
-
硫酸是一种重要的化工产品,目前主要采用“接触法”进行生产.下列对于反应 2SO2+O2
2SO3的说法中正确的是( )
A.只要选择适宜的条件,SO2和O2就能全部转化为SO3
B.在工业合成SO3时,要同时考虑反应速率和反应能达到的限度两方面的问题
C.该反应达到平衡后,反应就完全停止了,即正逆反应速率均为零
D.在达到平衡的体系中,充入由18O原子组成的O2后,18O仅存在于SO2和SO3中
难度: 中等查看答案及解析
-
在加热、催化剤作用下2SO2(g)+O2(g)
2SO3(g)下列说法不正确的是( )
A.在相同条件下,该反应中分别用SO2和O2表示的v,数值不同,但该反应的快慢程度是一致的
B.该反应加入催化剂的目的是为了加快反应速率
C.为了提高SO2的转化率,减少污染物的排放,常常在实际生产中,O2和SO2的投入量之比大于1:2
D.在密闭容器中,投入2 mol SO2和l mol O2,反应结束时生成的2 mol SO3
难度: 中等查看答案及解析
-
已知反应:2CH3COCH3(l)
 CH3COCH2COH(CH3)2(l)。取等量CH3COCH3,分别在0 ℃和20 ℃下,测得其转化分数随时间变化的关系曲线(Y-t)如图所示。下列说法正确的是
CH3COCH2COH(CH3)2(l)。取等量CH3COCH3,分别在0 ℃和20 ℃下,测得其转化分数随时间变化的关系曲线(Y-t)如图所示。下列说法正确的是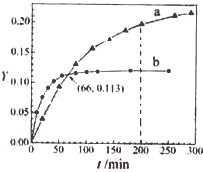
A.b代表
下CH3COCH3的Y-t曲线
B.反应进行到20min末,H3COCH3的
C.升高温度可缩短反应达平衡的时间并能提高平衡转化率
D.从Y=0到Y=0.113,CH3COCH2COH(CH3)2的
难度: 中等查看答案及解析
-
黑火药是中国古代的四大发明之一,其爆炸的热化学方程式为:S(s)+2KNO3(s)+3C(s)=K2S(s)+N2(g)+3CO2(g) △H=x kJ/mol
已知:碳的燃烧热△H1=a kJ/mol
S(s)+2K(s)=K2S(s) △H2=b kJ/mol
2K(s)+N2(g)+3O2(g)=2KNO3(s) △H3=c kJ/mol,则x为( )
A.a+b-c B.c-3a-b
C.3a+b-c D.c-a-b
难度: 中等查看答案及解析
-
图中曲线分别表示相同温度下,压强为P1、P2条件下发生可逆反应:mX(g)+nY(g)
2Z(g)+W(s)的过程。下列说法不正确的是( )
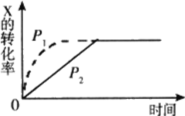
A.P1>P2 B.m+n=2
C.m+n=3 D.P1、P2下平衡常数相同
难度: 中等查看答案及解析
-
对于A2+3B2═2C的反应来说,以下化学反应速率的表示中,反应速率最快的是( )
A.v(B2)=0.9 mol/(L⋅s) B.v(A2)=0.5 mol/(L⋅s)
C.v(C)=0.62 mol/(L⋅s) D.v(B2)=4.2 mol/(L⋅min)
难度: 简单查看答案及解析
-
“低碳经济”是以低能耗、低污染、低排放为基础的可持续发展经济模式。下列说法与“低碳经济”不符合的是( )
A. 大力研发新型有机溶剂替代水作为萃取剂
B. 加强对煤、石油、天然气等综合利用的研究,提高燃料的利用率
C. 利用CO2合成聚碳酸酯类可降解塑料,实现“碳”的循环利用
D. 甲烷和乙醇的燃烧热分别是891.0 kJ·mol-1、1366.8 kJ·mol-1,利用甲烷更“低碳”
难度: 简单查看答案及解析
-
某密闭容器中发生如下反应:X(g)+3Y(g)
2Z(g);△H<0。如图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量,下列说法中不正确的是( )
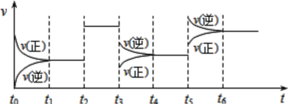
A.t3时减小了压强 B.t5时升高了温度
C.t2时加入了催化剂 D.t4~t5时间内转化率最低
难度: 中等查看答案及解析
-
已知N2(g)+3H2(g)
2NH3(g)△H<0。若合成氨厂将此反应的工艺条件定为:①反应温度:300℃;②反应压强:300 atm;③使用铁作催化剂,其中不是从有利于提高NH3平衡浓度来考虑的是( )
A.①② B.①③ C.②③ D.①②③
难度: 简单查看答案及解析
-
化学反应中,有时存在“一种物质过量,另一种物质仍不能完全反应”的情况,下列反应中属于这种情况的是( )
A. 过量的锌与稀硫酸反应
B. 过量的氢气与少量氮气在一定条件下充分反应
C. 过量稀醋酸与碳酸钠溶液反应
D. 过量稀硝酸与铜反应
难度: 简单查看答案及解析
-
下列说法正确的是( )
A.1 mol 硫酸与1mol Ba(OH)2 完全中和所放出的热量为中和热
B.在25℃、101kPa下,1 mol 硫和2 mol硫燃烧热相等
C.CO是不稳定的氧化物,它能继续和氧气反应生成稳定的CO2,所以CO的燃烧反应一定是吸热反应
D.101 kPa时,1 mol 碳燃烧所放出的热量为碳的燃烧热
难度: 中等查看答案及解析
-
下列相关实验不能达到预期目的是( )
相关实验
预期目的
A.
等质量的锌粒和锌片分别与等体积的盐酸反应
探究接触面积对化学反应速率的影响
B.
把装有颜色相同的NO2和N2O4混合气的两支试管(密封)分别浸入冷水和热水中
探究温度对化学平衡的影响
C.
向FeCl3和KSCN反应后的混合液中加入少量NaOH溶液
探究浓度对化学平衡的影响
D.
两支试管中各加入4 mL 0.01 mol/LKMnO4酸性溶液和2 mL 0.1 mol/LH2C2O4溶液,向其中一支试管中加入少量MnSO4固体
探究催化剂对反应速率的影响
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
下列关于化学反应的描述中正确的是( )
A.需要加热才能发生的反应一定是吸热反应
B.已知NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) △H=-57.3 kJ/mol,则含40.0 g NaOH的稀溶液与稀醋酸完全中和,放出57.3 kJ的热量
C.CO(g)的燃烧热是283.0 kJ/mol,则表示CO(g)的燃烧热的热化学方程式为2CO(g)+O2(g)=2CO2(g) △H=-283.0 kJ/mol
D.已知2C(s)+2O2(g)=2CO2(g) △H=a,2C(s)+O2(g)=2CO(g) △H=b,则b>a
难度: 中等查看答案及解析
-
某温度下,可逆反应mA(g)+nB(g)
pC(g)的平衡常数为K,下列对K的说法正确的是
A.K值越大,表明该反应越有利于C的生成,反应物的转化率越大
B.若缩小反应器的容积,能使平衡正向移动,则K增大
C.温度越高,K一定越大
D.如果m+n=p,则K=1
难度: 简单查看答案及解析
-
把0.6 mol气体X和0.4 mol气体Y混合于2.0 L的密闭容器中,发生反应:3X(g)+Y(g) =nZ(g)+2W(g),测得5 min末已生成0.2 mol W,又知以Z表示的平均反应速率为 0.01 mol·L-1·min-1,则n值是( )
A.1 B.2 C.3 D.4
难度: 简单查看答案及解析
-
断裂1 mol化学键所需的能量如下:
化学键
N—N
O=O
N≡N
N—H
键能(kJ)
154
500
942
a
火箭燃料肼(H2N—NH2)的有关化学反应的能量变化如图所示,则下列说法错误的是
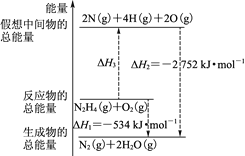
A.N2比O2稳定
B.N2H4(g)+O2(g)=N2(g)+2H2O(g) ΔH=-534 kJ·mol-1
C.表中的a=194
D.图中的ΔH3=+2218 kJ·mol-1
难度: 中等查看答案及解析
-
中和反应反应热的测定中使用0.50 mol/L的酸和0.55 mol/L的碱。在相同的条件下,下列测定结果最接近57.3 kJ·mol-1的是
A.用H2SO4和Ba(OH)2
B.用CH3COOH和Ba(OH)2
C.用盐酸和NaOH
D.用CH3COOH和NaOH
难度: 中等查看答案及解析
-
下列实验装置(夹持装置略去)选择正确且能达到相应实验目的的是
A. 测定中和热
 B. 测定反应速率
B. 测定反应速率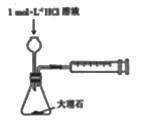 C. 实现化学能转化为电能
C. 实现化学能转化为电能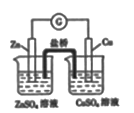 D. 测定食醋的浓度
D. 测定食醋的浓度
难度: 中等查看答案及解析
-
下列说法正确的是( )
A.测定HCl和NaOH中和反应的反应热时,单次实验均应测量3个温度,即盐酸起始温度、NaOH溶液起始温度和反应终止温度
B.2C(s)+O2(g)=2CO(g) 若△H=-221.0kJ/mol,则碳的燃烧热为110.5kJ/mol
C.需要加热的反应一定是吸热反应,常温下能发生的反应一定是放热反应
D.已知Ⅰ:反应H2(g)+Cl2(g)=2HCl(g) △H=-akJ/mol;Ⅱ:
 ,
, 且a、b、c均大于零,则断开1molH-Cl键所需的能量为2(a-b-c)kJ/mol
且a、b、c均大于零,则断开1molH-Cl键所需的能量为2(a-b-c)kJ/mol难度: 简单查看答案及解析
-
一定条件下,A、B、C的起始浓度分别是0.5mol/L、0.1 mol/L、1.6mol/L,可逆反应A(g)+B(g)
2C(g)达到平衡时,下列数据合理的是
A.c(A)=1.0mol/L c(B)=0.2mol/L B.c(B)=0.5mol/L c(C)=1.2mol/L
C.c(A)=0.4mol/L c(C)=1.8mol/L D.c(A )=0.9mol/L c(B)=0.5mo/L
难度: 中等查看答案及解析
-
某温度时,N2+3H2
2NH3的平衡常数K=a,则此温度下,NH3
H2+
N2的平衡常数为 ( )
A.
B.
C.a D.a —2
难度: 简单查看答案及解析
-
在密闭容器中,对于反应2NO2(g)
N2O4(g) △H<0,增大压强(体积迅速减小),下列说法正确的是( )
A.平衡逆向移动
B.混合气体颜色比原来深
C.混合气体颜色比原来浅
D.混合气体的平均相对分子质量变小
难度: 简单查看答案及解析