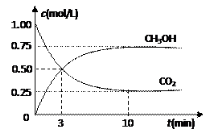-
随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2 的含量及有效地开发利用CO2 ,引起了各国的普遍重视。
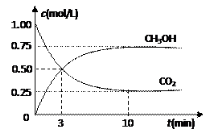
(1)目前工业上有一种方法是用CO2 来生产燃料甲醇。为探究反应原理,现进行如下实验,
在体积为1 L的密闭容器中,充入1mol CO2 和3mol H2 ,一定条件下发生反应:
CO2 (g)+3H2 (g) CH3OH(g)+H2O(g) △H=-49.0kJ/mol
CH3OH(g)+H2O(g) △H=-49.0kJ/mol
测得CO2 和CH3OH(g)的浓度随时间变化如图所示。
①从反应开始到平衡,氢气的平均反应速率 v (H2 )=___________mol/(L·min)。
②该反应的平衡常数表达式为__________________。
③下列措施中能使 n(CH3OH)/n(CO2)增大的是___________。
A.升高温度 B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离 D.再充入1molCO2 和3molH2
(2)①在载人航天器的生态系统中,不仅要求分离去除CO2 ,还要求提供充足的O2 。某种电化学装置可实现如下转化:2CO2 =2CO+O2 ,CO可用作燃料。
已知该反应的阳极反应为:4OH— —4e— =O2↑+2H2O
则阴极反应式为:____________________________。
②有人提出,可以设计反应2CO=2C+O2 (△ H >0、△S<0)来消除CO的污染。请你判断是否可行并说出理由:_________;____________________________________。
-
随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视。
Ⅰ.目前工业上有一种方法是用CO2来生产燃料甲醇。为探究该反应原理,进行如下实验,在体积为1L的密闭容器中,充入1mol CO2和3.25 mol H2,在一定条件下发生反应,测定CO2、CH3OH(g)和H2O(g)的浓度随时间变化如下图所示:
(1)从反应开始到平衡,氢气的平均反应速率 = mol/(L·min)
= mol/(L·min)
(2)该条件下CO2的转化率为 。
(3)下列措施中能使n(CH3OH)/n(CO2)增大的是 。
A.升高温度
B.恒容时充入氮气
C.将水蒸气从体系中分离
D.用更有效的催化剂
Ⅱ.下图是一个乙醇燃料电池工作时的示意图,乙池中的两个电极一个是石墨电极,一个是铁电极,工作时M、N两个电极的质量都不减少,请回答下列问题:[Ag:108]
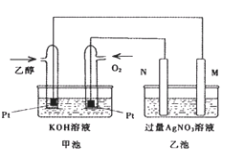
(1)M极的电极材料为 。
(2)加入乙醇的铂电极的电极反应式为
(3)在 此过程中乙池中某一电极析出金属银4.32g时,此时乙池 溶液的体积为400mL,则乙池中溶液的pH为 。
此过程中乙池中某一电极析出金属银4.32g时,此时乙池 溶液的体积为400mL,则乙池中溶液的pH为 。
(4)若在常温常压下,1g C2H5OH燃烧生成CO2和液态H2O时放出 29.71kJ热量,表示该反应的热化学方程式为 。
-
随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视。目前工业上有一种方法是用CO2来生产燃料甲醇。为探究反应原理,现进行如下实验,在485℃时,在体积为1 L的密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应合成甲醇:
(1)请完成CO2和3mol H2反应合成甲醇的热化学方程式:
CO2(g)+3H2(g)  CH3OH(g)+______( ),△H=-49.0kJ/mol
CH3OH(g)+______( ),△H=-49.0kJ/mol
(2)测得CO2和CH3OH(g)的浓度随时间变化如图所示。

①从反应开始到平衡,氢气的平均反应速率v(H2)= ___________mol/(L·min)。
②该反应的平衡常数表达式为__________________。
③据图中提供的数据计算在该温度下的K值。要有计算过程。(保留三位有效数字)
(3)能判断该反应是否达到化学平衡状态的依据是___________(多选扣分)
A.容器中压强不变的状态 B.混合气体中c(CO2)不变的状态
C.V逆(H2O)=3 V正 (H2) D.混合气体的密度保持不变的状态
E.用CO2、H2、CH3OH的物质的量浓度变化表示的反应速率的比为1:3:1的状态
F.混合气体的平均相对分子质量不再改变的状态
(4)下列措施中能使n(CH3OH)/n(CO2)增大的是___________。
A.升高温度 B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离 D.再充入1mol CO2和3mol H2
-
随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视。
⑴目前工业上有一种方法是用CO2来生产燃料甲醇。为探究反应原理,现进行如下实验,在体积为1 L的密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H=-49.0kJ/mol,测得CO2和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g) △H=-49.0kJ/mol,测得CO2和CH3OH(g)的浓度随时间变化如图所示。
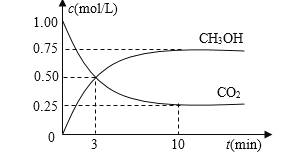
①从反应开始到平衡,氢气的平均反应速率v(H2)=_____mol/(L·min)。
②该反应的平衡常数表达式为K=_________。
③下列措施中能使n(CH3OH)/n(CO2)增大的是___________。
A.升高温度 B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离 D.再充入1mol CO2和3mol H2
⑵有人提出,可以设计反应2CO(g)=2C(s)+O2(g) 通过其自发进行来消除CO的污染。该方案_______(填“是”、“否”)可行,理由是:_______。
-
(共12分)随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视。
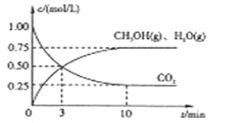
Ⅰ.目前工业上有一种方法是用CO2来生产燃料甲醇。为探究该反应原理,进行如下实验,在体积为1L的密闭容器中,充入1mol CO2和3.25 mol H2,在一定条件下发生反应,测定CO2、CH3OH(g)和H2O(g)的浓度随时间变化如下图所示:
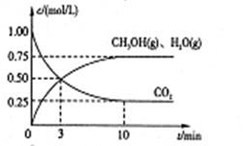
(1)从反应开始到平衡,氢气的平均反应速率 =________ mol/(L·min)
=________ mol/(L·min)
(2)该条件下CO2的转化率为________。
(3)下列措施中能使n(CH3OH)/n(CO2)增大的是________。
A.升高温度 B.恒容时充入氮气
C.将水蒸气从体系中分离 D.用更有效的催化剂
Ⅱ.下图是一个乙醇燃料电池工作时的示意图,乙池中的两个电极一个是石墨电极,一个是铁电极,工作时M、N两个电极的质量都不减少,请回答下列问题:

(1)M极的电极材料为 ________。
(2)加入乙醇的铂电极的电极反应式为________。
(3)在此过程中乙池中某一电极析出金属银4.32g时,此时乙池溶液的体积为400mL,则乙池中溶液的pH为________。
(4)若在常温常压下,1g C2H5OH燃烧生成CO2和液态H2O时放出29.71kJ热量,表示该反应的热化学方程式为________。
-
(1)随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍关注, 目前工业上有一种方法是用CO2来生产燃料甲醇。为探究反应原理,现进行如下实验:在体积为1 L的密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H=-49.0kJ/mol
CH3OH(g)+H2O(g) △H=-49.0kJ/mol
测得CO2和CH3OH(g)的浓度随时间变化如图所示。
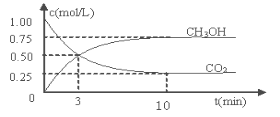
平衡时H2的转化率为 ___________ 。
反应进行到3 min时,同种物质的v正 与v逆的关系: v正 v逆(填>,=,<)
③ 上述反应平衡常数的表达式为 ,经计算该温度下此反应平衡常数的数值为 。
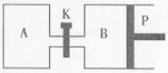
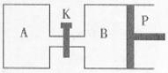
(2)如图装置,A、B中电极为多孔的惰性电极;C、D为夹在湿的Na2SO4滤纸条上的铂夹;电源有a、b两极。若在A、B中充满KOH溶液后倒立于KOH溶液的水槽中,切断K1,闭合K2、K3,通直流电,一段时间后试管中产生气体,如图所示,据此分析:

B试管中的气体是_____(填名称或分子式);a为电源________(正或负)极。
写出电解时A极的电极反应式: __________________。
③若电解一段时间,A、B中均有气体包围电极。此时切断K2、K3,闭合K1。电流表的指针偏转,则此时B极电极反应式为_________________。
(3)甲烷燃料电池可以提升能量利用率.如图所示是利用甲烷燃料电池电解50ml2mol/L的氯化铜溶液的装置示意图:
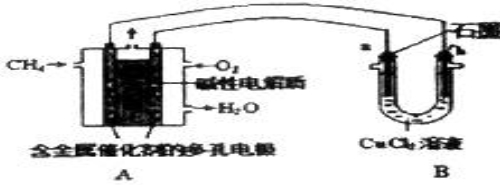
请回答:
甲烷燃料电池的负极反应式是: .
当A中消耗0.05mol氧气时,B中 极(填“a”或“b”)增重 g.
-
(10分)降低大气中CO2的含量及有效利用CO2,目前已引起各国普遍重视。
(1)工业上有一种方法是用CO2来生产燃料甲醇。为探究反应原理,现进行如下实
验,在体积为1 L的密闭容器中,充入1 mol CO2和3 mol H2,在500℃下发生
反应:CO2(g)+3H2(g)  CH3OH(g)+H2O(g) 。
CH3OH(g)+H2O(g) 。
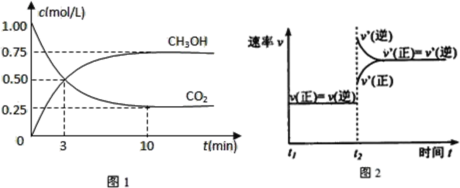
实验测得CO2(g)和CH3OH(g)的浓度随时间变化如下图1所示。
①图2是改变温度时H2的化学反应速率随时间变化的示意图,则该反应的正反
应是 (填“吸热”或“放热”)反应。
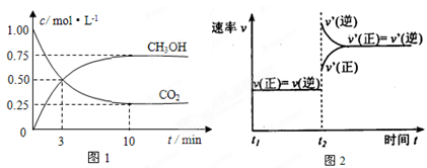
②500℃达平衡时,CH3OH的体积分数为 。
(2)下图中P是可自由平行滑动的活塞,关闭K,在相同温度时,向A容器中充入1molCH3OH(g)和2molH2O(g),向B容器中充入1.2molCH3OH(g) 和2.4molH2O(g),两容器分别发生上述(1)中反应的逆反应。
已知:起始时容器A和B的体积均为aL,反应达到平衡时容器B的体积为1.5aL,容器B中CH3OH转化率为 ;维持其他条件不变,若打开K一段时间后重新达到平衡,容器B的体积为 L(连通管中气体体积忽略不计,且不考虑温度的影响)。
-
随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍关注。
(1)目前工业上有一种方法是用CO2来生产燃料甲醇。为探究反应原理,现进行如下实验:在体积为1 L的密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:
CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H=-49.0kJ/mol
CH3OH(g)+H2O(g) △H=-49.0kJ/mol
测得CO2和CH3OH(g)的浓度随时间变化如图所示。
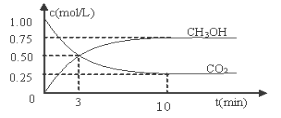
①反应开始到平衡,H2的平均反应速率v(H2)=___________mol/(L·min)。
②H2的转化率为 _____ 。
③下列措施中能使n(CH3OH)/n(CO2)增大的是___________。
A升高温度 B充入He(g),使体系压强增大
C将H2O(g)从体系中分离 D再充入1mol CO2和3mol H2
E使用催化剂 F缩小容器体积
(2)①反应进行到3 min时,同种物质的v正 与v逆的关系: v正 v逆(填>,=,<)。
②上述反应平衡常数的表达式为 ,经计算该温度下此反应平衡常数的数值为 。
-
随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍关注
(1)目前工业上有一种方法是用CO2来生产燃料甲醇.为探究反应原理,现进行如下实验:在体积为1L的密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:
CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)△H=-49.0kJ/mol
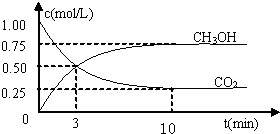
测得CO2和CH3OH(g)的浓度随时间变化如图所示.
①反应开始到平衡,H2的平均反应速率v(H2)=______mol/.H2的转化率为______.
②下列措施中能使n(CH3OH)/n(CO2)增大的是______.
A、升高温度 B、充入He(g),使体系压强增大
C、将H2O(g)从体系中分离 D、再充入1mol CO2和3mol H2
E、使用催化剂 F、缩小容器体积
(2)①反应进行到3分钟时,同种物质的v正 与v逆的关系:v正______v逆 (填>,=,<)
②上述反应平衡常数的表达式为______,经计算该温度下此反应平衡常数的数值为______.
-
(10分)降低大气中CO2的含量及有效利用CO2,目前已引起各国普遍重视。
(1)工业上有一种方法是用CO2来生产燃料甲醇。为探究反应原理,现进行如下实
验,在体积为1 L的密闭容器中,充入1 mol CO2和3 mol H2,在500℃下发生
反应:CO2(g)+3H2(g)  CH3OH(g)+H2O(g) 。
CH3OH(g)+H2O(g) 。
实验测得CO2(g)和CH3OH(g)的浓度随时间变化如下图1所示。
①图2是改变温度时H2的化学反应速率随时间变化的示意图,则该反应的正反
应是 (填“吸热”或“放热”)反应。
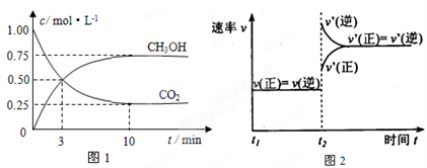
②500℃达平衡时,CH3OH的体积分数为 。
(2)下图中P是可自由平行滑动的活塞,关闭K,在相同温度时,向A容器中充入1molCH3OH(g)和2molH2O(g),向B容器中充入1.2molCH3OH(g) 和2.4molH2O(g),两容器分别发生上述(1)中反应的逆反应。
已知:起始时容器A和B的体积均为aL,反应达到平衡时容器B的体积为1.5aL,容器B中CH3OH转化率为 ;维持其他条件不变,若打开K一段时间后重新达到平衡,容器B的体积为 L(连通管中气体体积忽略不计,且不考虑温度的影响)。
CH3OH(g)+H2O(g)。实验测得CO2(g)和CH3OH(g)的浓度随时间变化如图1所示。
CH3OH(g) △H=-90.8kJ⋅mol-1
CH3OCH3(g)+H2O(g) △H=-23.5kJ⋅mol-1
CO2(g)+H2(g) △H=-41.3kJ⋅mol-1
CH3OCH3(g)+H2O(g)在某温度下的平衡常数K=400。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下: