-
已知X、Y、Z、W是短周期元素。X元素原子的2p能级处于半充满状态;Y元素原子最外电子层(L电子层)上s电子数和p电子数相等;Z元素的+2价阳离子的核外电子排布与氖原子相同;W元素原子的M电子层有1个未成对的p电子。下列说法一定正确的是( )
A.含有X元素的化合物一定是共价化合物
B.Y元素的电负性大于X元素的电负性
C.X元素的单质与Z元素的单质在一定条件下能发生化合反应
D.W元素的单质能与NaOH溶液反应放出氢气
难度: 中等查看答案及解析
-
现有四种元素的基态原子的电子排布式如下:
①1s22s22p63s23p4 ②1s22s22p63s23p3 ③1s22s22p3 ④1s22s22p5
则下列有关比较中正确的是
A.第一电离能:④>③>②>①
B.原子半径:④>③>②>①
C.电负性:④>③>②>①
D.最高正化合价:④>③=②>①
难度: 中等查看答案及解析
-
根据电子排布的特点,Cr在周期表中属于( )
A.ds区 B.p区 C.d区 D.s区
难度: 简单查看答案及解析
-
下列分子或离子中键角由大到小的排列顺序是( )
①SO2 ②NH3 ③H2O ④CH4 ⑤CO2
A.⑤④①②③ B.⑤①④②③ C.④①②⑤③ D.③②④①⑤
难度: 简单查看答案及解析
-
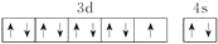
下列说法或有关化学用语的表述正确的是( )
A.次氯酸的电子式:
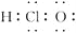
B.基态铜原子的外围电子排布图:
C.Se的简化电子排布式:[Ar]3d104s24p4
D.S原子的电子排布图为

难度: 简单查看答案及解析
-
下表中是A、B、C、D、E五种短周期元素的某些性质,下列判断正确的是( )
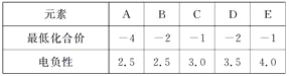
A.C、D、E的氢化物的稳定性:C>D>E
B.元素A的原子最外层轨道中无自旋状态相同的电子
C.元素B、C之间不可能形成化合物
D.与元素B同周期且第一电离能最小的元素的单质能与H2O发生置换反应
难度: 中等查看答案及解析
-
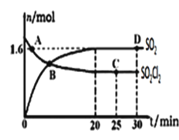
相同条件下,0.1mol·L-1Na2S2O3溶液和0.1mol·L-1H2SO4溶液各5mL,与10mL水混合,反应速率为υ1mol·L-1·s-1;0.2mol·L-1Na2S2O3溶液和0.2mol·L-1H2SO4溶液各5mL,与30mL水混合,反应速率为υ2mol·L-1·s-1。则υ1和υ2的关系是( )
A.υ1>υ2 B.υ1<υ2 C.υ1=υ2 D.不能肯定
难度: 简单查看答案及解析
-
下列说法不正确的是( )
A.1g氢气在氧气中完全燃烧生成气态水,放出的热量为120.9kJ,氢气的燃烧热大于241.8kJ•mol-1
B.500℃、30MPa下,将0.5molN2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放出的热量为19.3kJ,其热化学方程式为N2(g)+3H2(g)=2NH3(g)ΔH=﹣38.6kJ·mol-1
C.常温下,若反应C(s)+CO2(g)=2CO(g)不能自发进行,则该反应的ΔH>0
D.已知中和热为57.3kJ·mol-1,若将含0.5molH2SO4的浓溶液与含1molNaOH的溶液混合,放出的热量要大于57.3kJ
难度: 中等查看答案及解析
-
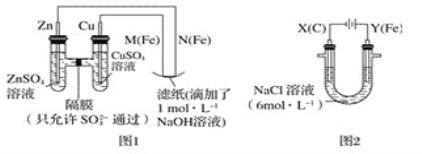
关于下列各装置图的叙述中,不正确的是
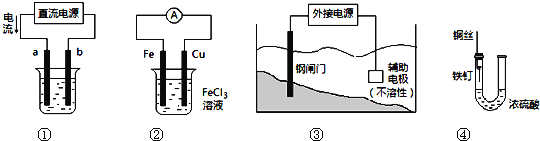
A.用装置①精炼铜,则a极为粗铜,电解质溶液为CuSO4溶液
B.装置②的总反应是:Cu+2Fe3+=Cu2++2Fe2+
C.装置③中钢闸门应与外接电源的负极相连
D.装置④中的铁钉几乎没被腐蚀
难度: 中等查看答案及解析
-
下列说法中正确的是( )
A.NO2、BF3、NCl3分子中没有一个分子中原子的最外层电子都满足了8电子稳定结构
B.P4和CH4都是正四面体型分子且键角都为109.5°
C.NH4+的电子式为
,离子呈平面正方形结构
D.NH3分子中有一对未成键的孤电子对,它对成键电子的排斥作用较强
难度: 中等查看答案及解析
-
常压下羰基化法精炼镍的原理为:Ni(s)+4CO(g)
Ni(CO)4(g)。230℃时,该反应的平衡常数K=2×10−5。已知:Ni(CO)4的沸点为42.2℃,固体杂质不参与反应。
第一阶段:将粗镍与CO反应转化成气态Ni(CO)4;
第二阶段:将第一阶段反应后的气体分离出来,加热至230℃制得高纯镍。
下列判断正确的是
A.增加c(CO),平衡向正向移动,反应的平衡常数增大
B.第一阶段,在30℃和50℃两者之间选择反应温度,选50℃
C.第二阶段,Ni(CO)4分解率较低
D.该反应达到平衡时,v生成[Ni(CO)4]=4v生成(CO)
难度: 困难查看答案及解析
-
下列微粒中中心原子的杂化方式和微粒的立体构型均正确的是( )
A.C2H4:sp、平面形 B.SO42-:sp3、三角锥形
C.ClO2-:sp2、V形 D.NO3-:sp2、平面三角形
难度: 简单查看答案及解析
-
在密闭容器中,进行下列反应:2A(g)+B(g)+C(g)
D(g)+E(g) ΔH>0,达到平衡后,下列说法中正确的是( )
A.若恒温定容情况下,充入一些稀有气体,压强增大,平衡向右移动
B.若恒温定压条件下,加入C,则C的转化率将增大
C.若定容升温,在新平衡体系中A的质量分数将减小
D.温度、压强和容积都相同时,在另一密闭容器中加入2molA、1molB、1molC,平衡时两个容器中D和E的浓度分别相等
难度: 中等查看答案及解析
-
硼砂是含结晶水的四硼酸钠,其阴离子Xm-(含B、O、H三种元素)的球棍模型如下图所示:下列叙述正确的是
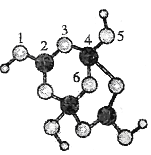
A.Xm-的化学式为B4O8H42-
B.硼原子轨道的杂化类型有sp2、 sp3
C.配位键存在于4、6原子之间
D.硼砂晶体中有离子键、配位键两种化学键
难度: 中等查看答案及解析
-
顺铂[Pt(NH3)2Cl2]是1969年发现的第一种具有抗癌活性的金属配合物;碳铂是1,1-环丁二羧酸二氨合铂(Ⅱ)的简称,属于第二代铂族抗癌药物,结构简式如图所示,其毒副作用低于顺铂。下列说法正确的是( )
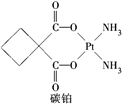
A. 碳铂中所有碳原子在同一个平面中
B. 顺铂分子中氮原子的杂化方式是sp2
C. 碳铂分子中sp3杂化的碳原子与sp2杂化的碳原子之比为2∶1
D. 1 mol 1,1-环丁二羧酸含有σ键的数目为12NA
难度: 中等查看答案及解析