-
(1)F2通入稀NaOH溶液中可生成OF2,OF2立体构型为___,其中氧原子的杂化方式为___。
(2)X、Y、Z、R为前四周期元素且原子序数依次增大。XY2是红棕色气体;X与氢元素可形成XH3;Z基态原子的M层与K层电子数相等;R2+离子的3d轨道中有9个电子。XY2-的立体构型是___;X与Z形成化合物中含有的化学键是___、R2+的水合离子中,提供孤电子对的原子是___。
(3)ClO3-的立体构型为___(用文字描述,下同);CO32-的立体构型是__。
(4)在BF3分子中:F—B—F的键角是___,B原子的杂化轨道类型为__,BF3和过量NaF作用可生成NaBF4,BF4-的立体构型为___。
(5)用价层电子对互斥理论推断,SnBr2分子中Sn—Br键的键角___(填“>”“<”或“=”)120°。其原因是___。
高二化学综合题中等难度题查看答案及解析
-
下列粒子的VSEPR模型为四面体,但空间立体构型为V形的是
A.OF2 B.CO2 C.SO2 D.NH4+
高二化学选择题中等难度题查看答案及解析
-
(1)在BF3分子中,F—B—F的键角是________,B原子的杂化轨道类型为________,BF3和过量NaF作用可生成NaBF4,BF4-的立体构型为________。
(2)按要求写出由第二周期元素为中心原子,通过sp3杂化形成中性分子的化学式(各写一种):正四面体分子__________,三角锥形分子__________,V型分子__________。
(3)已知白磷(P4)的结构为
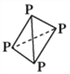 ,可知每个磷原子以___个共价键与另外的___磷原子结合成正四面体结构,它应该是________分子(填“极性”或“非极性”),在CS2中______(填“能”或“不能”)溶解,P原子的杂化方式为______________。
,可知每个磷原子以___个共价键与另外的___磷原子结合成正四面体结构,它应该是________分子(填“极性”或“非极性”),在CS2中______(填“能”或“不能”)溶解,P原子的杂化方式为______________。高二化学填空题中等难度题查看答案及解析
-
(1)①在BF3分子中,F—B—F的键角是________,B原子的杂化轨道类型为________,BF3和过量NaF作用可生成NaBF4,BF
的立体构型为________;
②在与石墨结构相似的六方氮化硼晶体中,层内B原子与N原子之间的化学键为________,层间作用力为________。
(2)①Y2X2(C2H2)分子中Y原子轨道的杂化类型为______,1 mol Y2X2含有σ键的数目为______。
②元素Y(C)的一种氧化物与元素Z(N)的一种氧化物互为等电子体,元素Z的这种氧化物的分子式为________。
③化合物ZX3(NH3)的沸点比化合物YX4(CH4)的高,其主要原因是______________________。
高二化学综合题中等难度题查看答案及解析
-
下列说法正确的是
A.P4和CH4的空间构型和键角都相同
B.O3与OF2都是V形分子
C.SO3和SeO32-的立体构型都是三角锥形
D.HOCH2CH(OH)CH2OH与CH3CHClCH2CH3都是手性分子
高二化学单选题中等难度题查看答案及解析
-
下列说法正确的是
A.P4和CH4的空间构型和键角都相同
B.O3与OF2都是V形分子
C.SO3和SeO32-的立体构型都是三角锥形
D.HOCH2CH(OH)CH2OH与CH3CHClCH2CH3都是手性分子
高二化学选择题中等难度题查看答案及解析
-
根据杂化轨道理论和价电子对互斥模型判断,下列分子或者离子的中心原子杂化方式及空间构型正确的是( )
选项
分子或离子
中心原子杂化方式
价电子对互斥模型
分子或离子的立体构型
A.
SO2
sp
直线形
直线形
B.
HCHO
sp2
平面三角形
三角锥形
C.
NF3
sp2
四面体形
平面三角形
D.
sp3
正四面体形
正四面体形
A. A B. B C. C D. D
高二化学单选题中等难度题查看答案及解析
-
根据杂化轨道理论和价电子对互斥模型判断,下列分子或者离子的中心原子杂化方式及空间构型正确的是( )
选项
分子或离子
中心原子杂化方式
价电子对互斥模型
分子或离子的立体构型
A.
SO2
sp
直线形
直线形
B.
HCHO
sp2
平面三角形
三角锥形
C.
NF3
sp2
四面体形
平面三角形
D.
sp3
正四面体形
正四面体形
A. A B. B C. C D. D
高二化学单选题中等难度题查看答案及解析
-
根据杂化轨道理论和价层电子对互斥模型,判断下列分子或者离子的立体构型正确的是( )
选项
分子式
中心原子
杂化方式
价层电子对
互斥模型
分子或离子
的立体构型
A
SO2
sp
直线形
直线形
B
HCHO
sp2
平面三角形
三角锥形
C
NF3
sp2
四面体形
平面三角形
D
NH4+
sp3
正四面体形
正四面体形
A. A B. B C. C D. D
高二化学单选题中等难度题查看答案及解析
-
根据杂化轨道理论和价层电子对互斥模型,判断下列分子或者离子的立体构型正确的是( )
选项
分子式
中心原子
杂化方式
价层电子对
互斥模型
分子或离子
的立体构型
A
SO2
sp
直线形
直线形
B
HCHO
sp2
平面三角形
三角锥形
C
NF3
sp2
四面体形
平面三角形
D
NH4+
sp3
正四面体形
正四面体形
A.A B.B C.C D.D
高二化学单选题中等难度题查看答案及解析