-
在不同浓度(c)、温度(T)条件下,蔗糖水解的瞬时速率(v)如下表。下列不正确的是
(T/K)/(v/mol·L-1·min-1) /( c/mol·L-1)
0.600
0.500
0.400
0.300
318.2
3.60
3.00
2.40
1.80
328.2
9.00
7.50
a
4.50
b
2.16
1.80
1.44
1.08
A. a=6.00
B. 同时改变反应温度和蔗糖的浓度,v可能不变
C. b<318.2
D. 不同温度时,蔗糖浓度减少一半所需的时间相同
难度: 困难查看答案及解析
-
有5种微粒,它们分别是
、
、
、
、
,则它们所属元素的种类有( )
A.2种 B.3种 C.4种 D.5种
难度: 简单查看答案及解析
-
《本草纲目》中的“石碱”条目下写道:“采蒿蓼之属,晒干烧灰,以水淋汁,久则凝淀如石,浣衣发面,亦去垢发面。”下列说法错误的是( )
A.“石碱”中含有离子键
B.“石碱”是离子化合物
C.“石碱”中含有极性共价键
D.“石碱”中含有非极性共价键
难度: 简单查看答案及解析
-
闪烁着银白色光泽的金属钛(22Ti)因具有密度小、强度大、无磁性等优良的机械性能,被广泛应用于军事、医学等领域,号称“崛起的第三金属”。已知钛有48Ti、49Ti、50Ti等同位素,下列关于金属钛的叙述中不正确的是( )
A.上述钛原子中,中子数不可能为22
B.钛元素在元素周期表中处于第四周期
C.钛的不同同位素在元素周期表中处于不同的位置
D.钛元素属于过渡元素
难度: 简单查看答案及解析
-
下列陈述的知识正确的是( )
A.C2H6与C3H8互为同系物,C2H4与C3H6也一定互为同系物
B.一种化合物不是电解质就一定是非电解质
C.离子化合物中可能含有共价键,共价化合物中也可能含有离子键
D.常温常压下,H2O是液态,H2S是气态,说明H2O的热稳定性更好
难度: 简单查看答案及解析
-
CH4与Cl2生成CH3Cl的反应过程中,中间态物质的能量关系如下图所示(Ea表示活化能),下列说法不正确的是
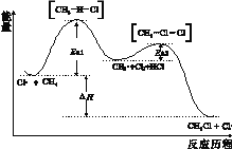
A. 已知Cl·是由Cl2在光照条件下化学键断裂生成的,该过程可表示为:

B. 相同条件下,Ea越大反应速率越慢
C. 图中ΔH<0,其大小与Ea1、Ea2无关
D. CH4转化为CH3Cl的过程中,所有C-H发生了断裂
难度: 中等查看答案及解析
-
下列说法不正确的是( )
A.纯净的水晶是由硅原子和氧原子构成的,每个原子的最外层均具有8电子稳定结构
B.Na2O是由离子构成的,其溶于水形成溶液的过程中既有离子键、共价键的断裂又有共价键的形成
C.现代科技已经能够拍到氢键的“照片”,直观地证实了水分子间的氢键是一个水分子中的氢原子与另一个水分子中的氧原子间形成的化学键
D.NH5中所有原子的最外层都符合相应的稀有气体原子的最外层电子结构,是既含有离子键又含有共价键的离子化合物
难度: 简单查看答案及解析
-
关于下列实验装置或操作的说法中,正确的是( )
A.图①实验室用MnO2固体与浓盐酸共热,制取并收集干燥、纯净的Cl2
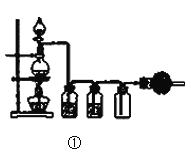
B.图②实验中若左边棉球变为橙色,右边棉球变为蓝色,则能证明非金属性:Cl>Br>I
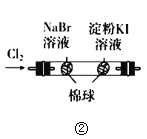
C.图③实验中试管内的溶液中会生成血红色沉淀
D.图④操作中可用酒精提取溴水中的溴
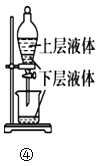
难度: 中等查看答案及解析
-
元素周期表中短周期主族元素W、X、Y、Z,原予序数依次增大,W的液态单质应用于航天领域,是火箭起飞的重要燃料;X元素原子的最外层电子数是内层电子数的3倍;元素Y在自然界中只能以化合态存在,而且元素Y在组成海水盐类物质的所有元素中,质量分数为第二;Z元素原子在同周期中原子半径最小。下列说法错误的是( )
A.Z的单质与W、Y的单质都能反应,且反应中Z的单质都作氧化剂
B.X的单质与Y的单质在常温条件下反应生成化合物甲,用电子式表示甲的形成过程为:
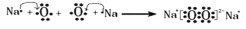
C.Y与W可以形成原子个数比为1:1的化合物乙,且乙与水反应有气体产生
D.W与X形成的含有极性共价键的化合物不只有一种
难度: 简单查看答案及解析
-
下列说法能说明反应2HI(g)
H2(g)+I2(g)已达到平衡状态的是( )
①单位时间内生成nmol H2的同时生成nmol HI
②一个H-H键断裂的同时有两个H-I键断裂
③当v正(HI)=2v逆(I2)时
④反应速率:v(H2)=v(I2)=0.5v(HI)
⑤当c(H2):c(I2):c(HI)=1:1:2时
⑥温度和体积一定时,某一生成物浓度不再变化
⑦温度和体积一定时,容器内压强不再变化
⑧温度和体积一定时,混合气体的平均相对分子质量不再变化
⑨温度和体积一定时,混合气体的颜色不再发生变化
⑩温度和压强一定时,混合气体的密度不再发生变化
A.②③⑥⑨ B.①②⑤⑨⑩ C.③⑥⑦⑩ D.②⑥⑧⑨
难度: 简单查看答案及解析
-
工业上制备纯硅反应的热化学方程式如下:SiCl4(g)+2H2(g)
Si(s)+4HCl(g) △H=+Q kJ/mol(Q>0),等温、恒压条件下,将一定量反应物通入密闭容器进行上述反应,下列叙述正确的是( )
A.反应过程中,若充入与反应无关的气体,由于保持压强不变,则反应速率不变
B.若反应开始时SiCl4为1mol,则达平衡时,吸收热量为Q kJ
C.当反应吸收热量为0.025Q kJ时,生成的HCl通入100mL1mol/L的NaOH溶液恰好完全反应
D.反应至4min时,若HCl浓度为0.12mol/L,则0~4min内H2的反应速率为0.03moL/(L∙min)
难度: 简单查看答案及解析
-
一种新型燃料电池,以镍板为电极插入KOH溶液中,分别向两极通入乙烷(C2H6)和氧气,其中某一电极反应式为:C2H6+18OH--14e-=2CO
+12H2O。有关此电池的推断不正确的是( )
A.通入乙烷的电极为负极
B.放电一段时间后,KOH的物质的量浓度将下降
C.参加反应的O2与C2H6的质量比为32:105
D.溶液中的OH-向负极移动
难度: 中等查看答案及解析
-
下列说法错误的是( )
A.烷烃的通式为CnH2n+2,随n值的增大,碳元素的质量分数逐渐增大
B.分子式为C2H6和分子式为C5H12的烷烃的一氯代物的数目不可能相同
C.丙烷的球棍模型为

D.
 和
和 属于同种物质
属于同种物质难度: 简单查看答案及解析
-
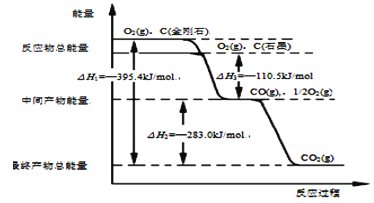
固态或气态碘分别与氢气反应的热化学方程式如下:
①H2(g)+I2(?)
2HI(g) ΔH1=-9.48 kJ·mol-1
②H2(g)+I2(?)
2HI(g) ΔH2=+26.48 kJ·mol-1
下列判断不正确的是( )
A.①中的I2为气态,②中的I2为固态
B.②的反应物总能量比①的反应物总能量低
C.反应①的产物比反应②的产物热稳定性更好
D.1 mol固态碘升华时将吸热35.96 kJ
难度: 简单查看答案及解析
-
向一支大试管中加入5mL0.1mol·L-1KI溶液和1mL0.1mol·L-1FeCl3溶液,用力振荡,为证明I-与Fe3+可发生可逆反应,下列实验设计不正确的是( )
A.取少量反应后的溶液于试管中,滴加淀粉溶液,观察现象
B.取少量反应后溶液于试管中,滴加0.1mol·L-1KSCN溶液,观察现象
C.取少量反应后溶液于试管中,滴加K3[Fe(CN)6]溶液(该溶液与Fe2+反应能产生蓝色沉淀),检验是否有Fe2+生成
D.取少量反应后溶液于试管中,滴加AgNO3溶液,观察现象
难度: 中等查看答案及解析
-
N2O、CO与Fe+体系中存在如图甲、乙所示的物质转变和能量关系。
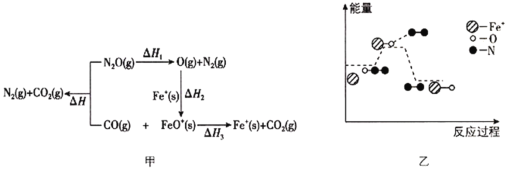
下列说法错误的是( )
A.由图甲可知,反应过程中存在ΔH=ΔH1+ΔH2+ΔH3
B.Fe+在反应中作催化剂,能降低反应的活化能
C.若已知ΔH与ΔH3均小于0,则可知ΔH1与ΔH2也均小于0
D.由图乙可知,反应Fe+(s)+N2O(g)=FeO+(s)+N2(g)的ΔH4<0
难度: 中等查看答案及解析
-
下列离子方程式书写正确且能合理解释事实的是( )
A.将铜丝插入稀硝酸中:Cu+4H++2NO3-=Cu2++2NO2↑+2H2O
B.向淀粉碘化钾溶液中滴加稀硫酸,在空气中放置一段时问后,溶液变蓝:4H++4I-+O2=2I2+2H2O
C.向Mg(HCO3)2溶液中加入过量NaOH溶液,产生白色沉淀:Mg2++2HCO
+2OH-=MgCO3↓+2H2O
D.向含0.1molFeBr2的溶液中通入0.1molCl2:2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-
难度: 中等查看答案及解析
-
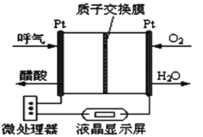
利用人工模拟光合作用合成甲酸的原理为2CO2+2H2O=2HCOOH+O2,装置如图所示,下列说法不正确的是( )
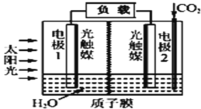
A.该装置能将太阳能转化为化学能和电能
B.电子由电极1经过负载流向电极2
C.电极2的反应式:CO2+2H++2e-=HCOOH
D.电极1周围pH增大
难度: 中等查看答案及解析
-
3mol A和2.5mol B混合于2L恒容的密闭容器中,保持温度不变发生的反应如下:3A(g)+B(g)
xC(g)+2D(g),反应5min达到平衡,容器内压强变小,测得D的平均反应速率为0.1mol/(L·min),下列结论正确的是( )
A.A的平均反应速率为0.10mol/(L·s)
B.平衡时,B的转化率为20%
C.平衡时,C的浓度为0.125mol/L
D.平衡时,容器内压强为原来的0.8倍
难度: 简单查看答案及解析
-
1 mol某烷烃在氧气中充分燃烧,需要消耗氧气246. 4 L (标准状况),它在光照的条件下与氯气反应,能生成4 种不同的一氯取代物,该烷烃的结构简式是
A.
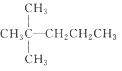 B.CH3CH2CH2CH2CH3
B.CH3CH2CH2CH2CH3C.
D.
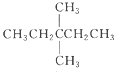
难度: 中等查看答案及解析