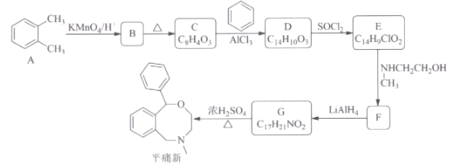
-
含有共价键的盐是( )
A.KOH B.HCl C.Na2SO4 D.MgCl2
难度: 简单查看答案及解析
-
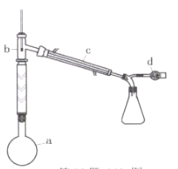
蒸馏含有Fe3+的自来水获得少量纯净的水,不需要用到的仪器是
A.
 B.
B. C.
C. D.
D.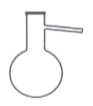
难度: 简单查看答案及解析
-
下列物质属于电解质,且能导电的是( )
A.熔融氯化钾 B.金属铜 C.酒精 D.液态氯化氢
难度: 简单查看答案及解析
-
反应4NO2+O2+2H2O=4HNO3中,被氧化的物质是( )
A.NO2 B.O2 C.H2O D.HNO3
难度: 简单查看答案及解析
-
下列物质的名称不正确的是( )
A.KAl(SO4)2·12H2O:明矾
B.Na2S2O3:硫代硫酸钠
C.CH3CH2OCH2CH3∶乙醚
D.(CH3)2CHCH2C(CH3)3:2,4,4-三甲基戊烷
难度: 中等查看答案及解析
-
下列表示正确的是
A.甲基的电子式∶
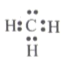
B.H2O的结构式∶
C.35Cl的结构示意图∶
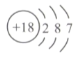
D.乙醇的球棍模型∶

难度: 简单查看答案及解析
-
下列说法正确的是( )
A.40K和40Ca互为同位素 B.O2和O22-互为同素异形体
C.
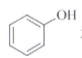 和
和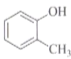 互为同系物 D.淀粉和纤维素互为同分异构体
互为同系物 D.淀粉和纤维素互为同分异构体难度: 简单查看答案及解析
-
下列说法不正确的是( )
A.纯碱是焙制糕点所用的发酵粉的主要成分之一
B.硫酸可用于金属矿石的处理和金属材料的表面清洗
C.还原铁粉可用作食品袋内的抗氧化剂
D.丙三醇俗称甘油,吸湿性强,可用于护肤
难度: 简单查看答案及解析
-
下列关于工业制备方法与化学方程式均正确的是( )
A.工业上用电解饱和食盐水的方法制取氯气:2NaCl
2Na + Cl2↑
B.工业上用乙醇在浓硫酸的作用下制取乙烯: CH3CH2OH
CH2=CH2↑+H2O
C.工业上用氢气还原四氯化硅制得高纯度的硅:SiCl4+2H2
Si+4HCl
D.工业以硫黄为原料生产硫酸,沸腾炉中的主要反应: 2S+3O2
2SO3
难度: 中等查看答案及解析
-
在2020年抗击新型冠状病毒肺炎的战役中,涉及很多化学知识。下列说法不正确的是( )
A.含有病毒的飞沫混合在空气中形成气溶胶,气溶胶能产生丁达尔效应
B.二氧化氯泡腾片可作为环境消毒剂,能使病毒失去生理活性
C.口罩的核心材料熔喷布的主要成分是聚丙烯,聚丙烯的链节为
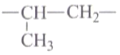
D.疫情期间,“网课"成了我们的主要学习方式,网络光纤的主要成分是晶体硅
难度: 中等查看答案及解析
-
下列有关说法不正确的是( )
A.稀释浓硫酸时,将浓硫酸慢慢倒入水中,用玻璃棒不断搅拌,同时佩戴护目镜
B.实验室中不慎将水银撒落地上,先尽可能收集,再用硫磺粉盖在洒落的地方
C.不慎服入含铜离子的盐,可服用豆浆或牛奶解毒
D.不慎将碱液倒到皮肤上,先用大量水冲洗,再用饱和碳酸氢钠溶液洗
难度: 简单查看答案及解析
-
下列离子方程式书写不正确的是( )
A.将石灰乳加入海水沉淀池得到氢氧化镁∶ Ca(OH)2+Mg2+=Mg(OH)2↓+Ca2+
B.用稀KMnO4酸性溶液检验火柴头燃烧产生的气体中含有SO2∶MnO4-+SO2+4H+=Mn2++SO42-+2H2O
C.泡沫灭火器反应原理∶3HCO3-+Al3+=3CO2↑+Al(OH)3↓
D.实验室用过量NaOH溶液吸收SO2∶2OH-+SO2=SO32-+H2O
难度: 中等查看答案及解析
-
下列说法不正确的是( )
A.石油经催化裂化得到的汽油能使溴水和酸性高锰酸钾溶液褪色
B.卤代烃、饱和一元醇都可发生消去反应,得到不饱和有机物
C.苯酚溶液可用氯化铁溶液或溴水检验
D.乙醛、乙酸、乙酸乙酯可用新制Cu(OH)2悬浊液鉴别
难度: 中等查看答案及解析
-
下列关于
 的说法,不正确的是
的说法,不正确的是A.该物质能发生加成、氧化、聚合等反应
B.该物质苯环上的一氯取代有4种同分异构体
C.该物质在酸性条件下水解产物之一可用于合成阿司匹林
D.1mol该物质与足量NaOH溶液反应,最多可消耗5molNaOH
难度: 中等查看答案及解析
-
X、Y、Z、R、M五种短周期主族元素,它们在周期表中位置如图所示,其中X次外层电子数是最外层的一半。下列说法不正确的是
X
Y
Z
R
M
A.原子半径由小到大的顺序∶ r(Y)<r(X)<r(Z)
B.X与M形成的简单化合物中各原子都具有8电子稳定结构
C.M的单核阴离子与Y的含氧酸的酸根离子用硝酸银溶液一定能鉴别
D.与R同主族的下一周期元素可作为半导体材料
难度: 中等查看答案及解析
-
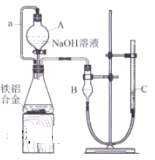
下列有关实验操作的说法,不正确的是( )
A.减压过滤中的转移,先开大水龙头,再用倾析法转移溶液至布氏漏斗中,待溶液快流尽时再转移沉淀
B.酸式滴定管的润洗,从滴定管上口加入3~ 5mL所要盛装液体,倾斜着转动滴定管,然后轻轻转动活塞,将液体从滴定管下部放入预置的烧杯中
C.振荡分液漏斗中的混合溶液,用一只手压住分液漏斗的玻璃塞,另一只 手握住旋塞,将分液漏斗倒转过来,用力振荡
D.焰色反应检验Na+,取一根铂丝,放在酒精灯火焰上灼烧至无色,然后蘸取少量试液,置于火焰上灼烧,观察火焰颜色
难度: 中等查看答案及解析
-
常温下,下列有关说法不正确的是( )
A.pH=11的氨水、NaOH溶液中,水电离产生的c(H+)相同
B.pH=3的HCl溶液与pH=11的氨水等体积混合,混合后溶液的pH小于7
C.pH=3的盐酸、CH3COOH溶液中,c(Cl-)= c(CH3COO-)
D.往10mL pH=3的盐酸中分别加入pH=11的氨水、NaOH溶液至中性,消耗氨水的体积小
难度: 中等查看答案及解析
-
2019年诺贝尔化学奖颁给了对锂离子电池研发作出卓越贡献的三位科学家。南开大学李福军研究团队以C3N4作为Li-O2可充电电池的光电极,提升了电池的能量效率,其充电工作原理如图所示。下列说法不正确的是( )
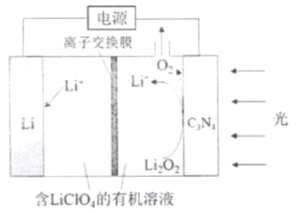
A.离子交换膜为阳离子交换膜
B.放电时,Li+移向Li电极
C.放电时,Li电极为负极,发生氧化反应
D.充电时,光电极的电极反应式为∶ Li2O2-2e-= 2Li++O2↑
难度: 简单查看答案及解析
-
在容积不变的容器中加入一定量的A和B,发生反应∶2A(g)+B(g)
2C(g), 在相同时间内,测得不同温度下A的转化率如下表所示,下列说法正确的是
温度/°C
100
200
300
400
500
转化率
30%
75%
75%
50%
18%
A.该反应随着温度升高,反应速率先变大后变小
B.200°C,A的转化率为75%时,反应达到平衡状态
C.当单位时间内生成n mol B的同时消耗2n molC时,反应达到平衡状态
D.400°C时,B的平衡浓度为0.5 mol/L,则该反应的平衡常数K=2
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值,已知∶CH3OH(g)+H2O(g)
CO2(g)+3H2(g),下列说法不正确的是( )
A.0.1 mol CH3OH中含共价键数为0.5NA
B.10.0g 质量分数为32%的CH3OH溶液与4.6g的钠反应,产生H2分子数为0.1NA
C.1 mol CH3OH与足量的H2O反应,得到CO2分子数为NA
D.每消耗0.1 mol CH3OH时,转移电子数为0.6NA
难度: 中等查看答案及解析
-
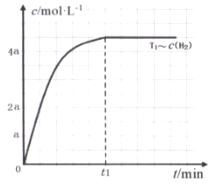
在某密闭容器中加入HBr,在一定条件下发生反应∶2HBr(g)
Br2(g)+H2(g), c(HBr)随反应时间的变化如曲线①所示,分别改变一个条件,得到曲线②、③,下列说法正确的是( )
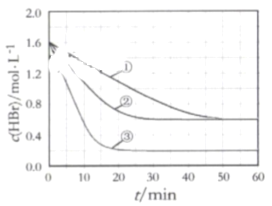
A.该反应正反应为放热反应
B.曲线①,0~ 50 min用H2表示的平均反应速率为0.02 mol﹒L-1﹒min-1
C.曲线②,可能使用了催化剂或增大了压强
D.曲线③达到平衡时,往容器中加入浓度均为0.2 mol﹒L-1的三种物质,平衡将向正反应方向移动
难度: 困难查看答案及解析
-
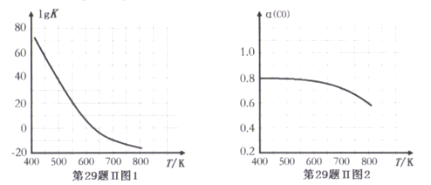
甲醇与水蒸气重整可获得清洁能源,在催化剂作用下发生如下两步反应∶
反应①∶CH3OH(g)==CO(g)+2H2(g) △H1
反应②∶CO(g) + H2O(g)==CO2(g)+H2(g) △H2
根据能量变化示意图,下列说法不正确的是( )
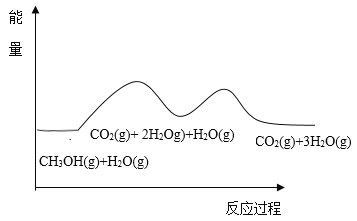
A.总反应的热化学方程式为∶ CH3OH(g)+H2O(g)=CO2(g)+3H2(g)
B.1mol CO(g)和1mol H2O(g)的总键能大于lmol CO2(g)和1mol H2(g)的总键能
C.甲醇与水蒸气催化重整的总反应速率取决于反应①
D.催化剂在反应中改变了活化能,加快了反应速率
难度: 中等查看答案及解析
-
室温下,向25.00 mL 0.1000 mol∙L−1氨水中滴加0.1000 mol∙L−1盐酸,溶液的pH随盐酸体积的变化如图。下列说法不正确的是( )
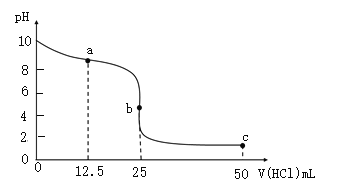
A.如选甲基橙为指示剂,终点的判断为溶液颜色由黄色恰好变为橙色且半分钟不变色
B.a→b,水的电离程度逐渐增大
C.a点溶液中,
c(H+)
D.c点溶液中,
难度: 简单查看答案及解析
-
过硝酸钠(NaNO4)能与水发生反应∶NaNO4+H2O= NaNO3+H2O2,下列说法不正确的是( )
A.过硝酸钠可用于杀菌消毒
B.过硝酸钠中含有-O-O-结构
C.过硝酸钠具有强氧化性,没有还原性
D.将过硝酸钠加入酸性FeSO4溶液中发生的离子方程式∶
难度: 中等查看答案及解析
-
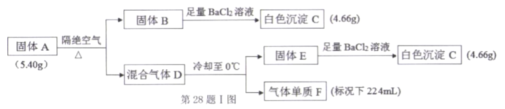
某固体混合物X,含有FeSO4、Fe(NO3)3、Al(NO3)3、NH4Cl、 Na2CO3 中的几种,进行如下实验:
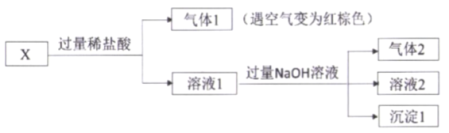
下列说法不正确的是
A.混合物X中必定含有NH4Cl、FeSO4,不含Na2CO3
B.灼烧沉淀1,可以得到红棕色物质
C.将足量的气体2通入溶液1中,将出现沉淀
D.往溶液2中通入足量的CO2,若没有出现沉淀,说明X中不含Al(NO3)3
难度: 困难查看答案及解析