-
下列有关化学用语表示正确的是( )
A.N2的电子式:
B.钠离子的结构示意图:
C.中子数为18的氯原子:
Cl
D.聚丙烯的结构简式:
难度: 简单查看答案及解析
-
室温下,下列各组离子在指定溶液中能大量共存的是( )
A.0.1mol·L-1NaHCO3溶液:Na+、Ba2+、NO3-、OH-
B.0.1mol·L-1NaAlO2溶液:K+、OH-、Cl-、NO3-
C.
=1.0×1012的溶液:Fe2+、Mg2+、NO3-、I-
D.0.1mol·L-1FeCl3溶液:K+、Cu2+、SCN-、Cl-
难度: 中等查看答案及解析
-
下列指定反应的离子方程式正确的是( )
A.向水中通入NO2:2NO2+H2O=2H++NO
+NO
B.向NH4HCO3溶液中加入过量NaOH溶液:HCO
+OH-=CO
+H2O
C.向稀硝酸中加入FeO:3FeO+NO
+10H+=3Fe3++NO↑+5H2O
D.向Na2SO3溶液中加入酸性K2Cr2O7溶液:3SO
+Cr2O
+2H2O=3SO
+2Cr3++6OH-
难度: 中等查看答案及解析
-
下列说法正确的是( )
A.碳素钢在海水中发生的腐蚀主要是析氢腐蚀
B.在铁制品表面镀锌时,铁制品与电源正极相连
C.NaHCO3溶液的水解方程式为:HCO
+H2O
CO
+H3O+
D.已知室温时Ksp[Mg(OH)2]=5.6×10-12,室温下pH=8的Mg(OH)2悬浊液中c(Mg2+)=5.6mol·L-1
难度: 简单查看答案及解析
-
下列物质的转化在给定条件下能实现的是( )
A.Fe2O3(s)
Fe(s)
FeCl2(aq)
B.Mg(OH)2
MgCl2(aq)
Mg
C.Cu2(OH)2CO3
CuO
Cu(OH)2
D.NaCl(aq)
NaHCO3(s)
Na2CO3(s)
难度: 困难查看答案及解析
-
在新型钴基电催化剂作用下,用石墨、铁做电极材料,可将CO2和水转化为甲酸。其反应原理如图所示,下列说法不正确的是( )
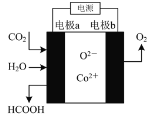
A.电极a为铁,与电源的负极相连
B.反应时化学能转化成电能
C.电极a上发生的反应为:CO2+2e-+2H2O=HCOOH+O2-
D.反应时,O2-向阳极处移动
难度: 中等查看答案及解析
-
现有下列氧化还原反应:
①2FeCl2+Cl2=2FeCl3
②2FeCl3+2KI=2FeCl2+2KCl+I2
③K2Cr2O7+14HCl(浓)=2KCl+2CrCl3+3Cl2↑+7H2O
根据上述反应判断下列结论正确的是( )
A.反应①中FeCl2为氧化剂
B.反应②中每消耗1molFeCl3,反应转移的电子数目为2×6.02×1023
C.反应③中氧化剂和还原剂的物质的量之比为1∶6
D.向FeI2溶液中通入足量Cl2,发生反应:Cl2+2Fe2+=2Cl-+2Fe3+
难度: 中等查看答案及解析
-
CO2催化加氢合成CH4的过程中主要发生下列反应:
①CH4(g)+2O2(g)
CO2(g)+2H2O(g) ΔH1=-802.0kJ·mol-1
②CO2(g)+H2(g)
CO(g)+H2O(g) ΔH2=+41.2kJ·mol-1
③2CO(g)+O2(g)
2CO2(g) ΔH3=-566.0kJ·mol-1
下列有关说法正确的是( )
A.CH4的燃烧热为802.0kJ·mol-1
B.反应②能自发进行的原因是ΔS<0
C.使用催化剂是为了提高CO2加氢时原料的平衡转化率
D.反应CO2(g)+4H2(g)=CH4(g)+2H2O(g)的ΔH=-165.2kJ·mol-1
难度: 中等查看答案及解析
-
下列实验操作能达到目的的是( )
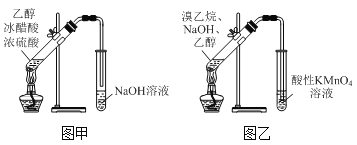
A.用灼烧的方法鉴别棉麻与真丝
B.加入浓溴水除去苯中溶解的杂质苯酚
C.用图甲装置制取并收集乙酸乙酯
D.用图乙装置验证溴乙烷与NaOH醇溶液共热产生了乙烯
难度: 中等查看答案及解析
-
短周期主族元素X、Y、Z、W原子序数依次增大,X的单质是相同条件下所有气体中密度最小的,Y原子的最外层电子数是其电子层数的3倍,Z元素在同周期元素中金属性最强,W与Y同一主族。下列说法正确的是( )
A.原子半径:r(W)>r(Z)>r(Y)
B.W的简单气态氢化物的热稳定性比Y的强
C.Z2Y2中阴阳离子的个数比为1∶2
D.X2W与Z2W所含化学键类型相同
难度: 中等查看答案及解析
-
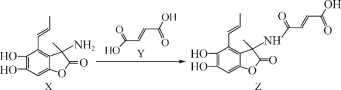
有机物Z是一种天然除草剂,可由X、Y在一定条件下反应制得。下列说法正确的是( )
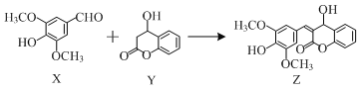
A.有机物X最多可与3molH2发生加成反应
B.可用FeCl3溶液鉴别X和Y
C.Y在Cu作催化剂条件下可被氧化为含醛基的物质
D.X与Y只通过加成反应即可生成Z
难度: 中等查看答案及解析
-
根据下列实验操作和现象所得到的结论正确的是( )
选项
实验操作和现象
结论
A
向一定浓度的Na2SiO3溶液中通入适量CO2气体,出现白色沉淀
酸性:H2SiO3>H2CO3
B
向溶液X中滴加氯水,再滴加KSCN溶液,溶液变红
溶液X中含Fe2+
C
向蛋白质溶液中加入甲醛溶液,有固体析出
蛋白质发生了盐析
D
卤代烃Y与NaOH水溶液共热后,加入足量稀硝酸,再滴入AgNO3溶液,产生白色沉淀
Y中含有氯原子
A.A B.B C.C D.D
难度: 中等查看答案及解析
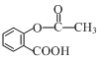 )是应用广泛的解热镇痛药,通过乙二醇将阿司匹林连接在高聚物E上,可制得缓释长效阿司匹林,其合成路线如图(部分反应条件已略去):
)是应用广泛的解热镇痛药,通过乙二醇将阿司匹林连接在高聚物E上,可制得缓释长效阿司匹林,其合成路线如图(部分反应条件已略去):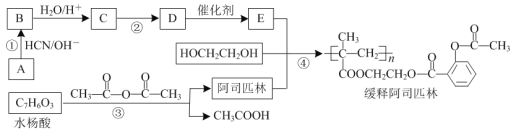
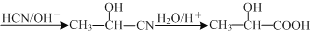
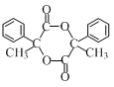 )的合成路线流程图___(无机试剂任用,合成路线流程图示例见本题题干)。
)的合成路线流程图___(无机试剂任用,合成路线流程图示例见本题题干)。
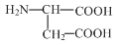 )和锌的化合物为原料制备。
)和锌的化合物为原料制备。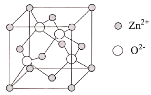
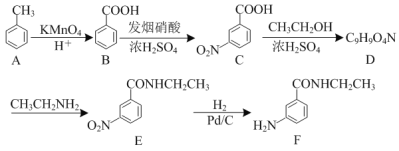
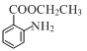 的合成路线流程图___(无机试剂任用,合成路线流程图示例见本题题干)。
的合成路线流程图___(无机试剂任用,合成路线流程图示例见本题题干)。