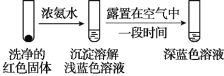
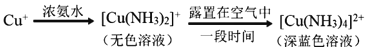-
下列能量的转化过程中,由化学能转化为电能的是
A
B
C
D




水力发电
风力发电
铅蓄电池放电
太阳能发电
A.A B.B C.C D.D
难度: 简单查看答案及解析
-
下列物质的水溶液能导电,但属于非电解质的是
A.CH3COOH B.CO2 C.NH4HCO3 D.Cl2
难度: 简单查看答案及解析
-
下列防止金属腐蚀的方法属于电化学防护的是
A.船体表面刷漆 B.加入铬、锰、硅等制成不锈钢
C.自行车链条涂油 D.水中的钢闸门连接电源的负极
难度: 简单查看答案及解析
-
只改变下列一个条件,可以通过提高活化分子的百分数来提高反应速率的是
A.加热 B.加压 C.减小容器体积 D.增大反应物浓度
难度: 中等查看答案及解析
-
在不同条件下分别测得反应 2SO2+O2
2SO3 的化学反应速率,其中表示该反应进行得最快的是( )
A.v (SO3)=4mol/(L·min) B.v (O2)=6mol/(L·min)
C.v (SO2)=8mol/(L·min) D.v (O2)=3mol/(L·min)
难度: 简单查看答案及解析
-
25℃时,下列溶液中水的电离程度最小的是( )
A.pH=11 的氨水 B.0.01 mol/L的 Na2CO3溶液
C.pH=2的NaHSO4溶液 D.0.1 mol/L的盐酸
难度: 简单查看答案及解析
-
下列溶液一定呈碱性的是
A.pH=8 的溶液 B.含有 OH-离子的溶液 C.c(OH-)>c(H+)的溶液 D.加酚酞显无色的溶液
难度: 简单查看答案及解析
-
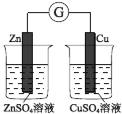
锌铜原电池装置如图所示,下列说法正确的是( )
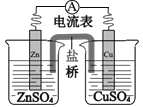
A.电流从锌片流向铜片
B.锌电极的反应式:Zn − 2e-=Zn2+
C.铜片作负极
D.盐桥的作用是传递电子
难度: 简单查看答案及解析
-
某可逆反应过程的能量变化如图所示,下列说法正确的是
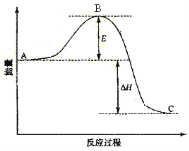
A.该反应正向为吸热反应
B.若升高温度,则平衡向正反应方向移动
C.若加入催化剂,ΔH 数值会减小
D.若加入催化剂,B 点会降低
难度: 简单查看答案及解析
-
如图所示,用石墨电极电解饱和食盐水。下列说法不正确的是( )
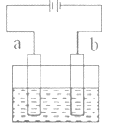
A.通电使NaCl 发生电离
B.电极a 是阳极
C.Na+向 b 极移动
D.a 极产生黄绿色气体
难度: 简单查看答案及解析
-
H2 与N2 在催化剂表面生成 NH3,反应历程及能量变化示意如下。

下列说法不正确的是
A.①→②吸收能量
B.②→③形成了N-H 键
C.该催化剂可提高NH3 的平衡产率
D.该反应为放热反应
难度: 简单查看答案及解析
-
下图所示的实验,能达到实验目的的是
A
B
C
D
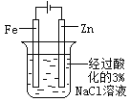
片刻后在 Fe 电极附近滴入铁氰化钾溶液
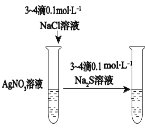
验证化学能转化为电能
证明温度对平衡移动的影响
验证 Fe 电极被保护
验证AgCl 溶解度大于Ag2S
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
已知下列热化学方程式:2Zn(s) + O2(g)=2ZnO(s) ΔH1=-702.2kJ/mol;2Hg(l) + O2(g)=2HgO ΔH2=-181.4kJ/mol,由此可知 Zn(s) + HgO(s) = ZnO(s) + Hg(l)的ΔH3,其中 ΔH3 的值是
A.-260.4 kJ/mol B.-254.6 kJ/mol C.-438.9 kJ/mol D.-441.8 kJ/mol
难度: 中等查看答案及解析
-
下列解释实验事实的方程式正确的是
A.氯气能使湿润的有色布条褪色:Cl2+H2O
2H+ + Cl− + ClO−
B.Na2S 溶液显碱性:S2- + 2H2O
H2S↑+ 2OH-
C.用氨水吸收烟气中的二氧化硫:SO2 + 2OH- = SO
+ H2O
D.铜片溶解在NaNO3 和稀盐酸的混合液中:3Cu + 8H+ + 2NO
=3Cu2+ + 2NO↑ + 4H2O
难度: 中等查看答案及解析
-
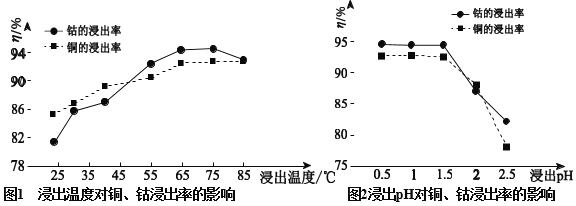
工业上可通过如下流程回收铅蓄电池中的铅,下列有关说法不正确的是
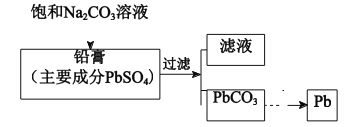
A.PbSO4 在水中存在溶解平衡:
B.生成PbCO3的离子方程式为:
C.pH:滤液 < 饱和 Na2CO3 溶液
D.滤液中不存在Pb2+
难度: 简单查看答案及解析
-
常压下羰基化法精炼镍的原理:Ni(s)+4CO(g)
Ni(CO)4(g)。230 ℃时,该反应的平衡常数 K=2×10-5。已知:Ni(CO)4 的沸点为 42.2 ℃,固体杂质不参与反应。
第一阶段:将粗镍与CO反应转化成气态Ni(CO)4;
第二阶段:将第一阶段反应后的气体分离出来,加热至 230 ℃制得高纯镍。下列判断正确的是
A.增加 c(CO),平衡向正向移动,反应的平衡常数增大
B.该反应达到平衡时,
生成[Ni(CO)4])=4
生成(CO)
C.第一阶段,在 30 ℃和 50 ℃两者之间选择反应温度,选50 ℃
D.第二阶段,Ni(CO)4分解率较低
难度: 中等查看答案及解析
-
新冠疫情期间某同学尝试在家自制含氯消毒剂。用两根铅笔芯(C1 和C2)、电源适配器和水瓶组装如图所示的装置。接通电源观察到:C1 周围产生细小气泡,C2 周围无明显现象;持续通电一段时间后,C2 周围产生细小气泡。此时停止通电,拔出电极,旋紧瓶塞,振荡摇匀,制备成功。关于该实验的说法不正确的是

A.C1电极产生气泡原因:
B.可以用两根铁钉代替铅笔芯完成实验
C.自制消毒剂的总反应为:NaCl+H2O
NaClO+H2↑
D.实验过程中要注意控制电压、开窗通风、导出氢气,确保安全
难度: 中等查看答案及解析
-
室温时,向 20 mL 0.1 mol·L− 1 的两种酸 HA、HB 中分别滴加0.1 mol·L− 1 NaOH 溶液, 其 pH 变化分别对应下图中的 I、II。下列说法不正确的是( )
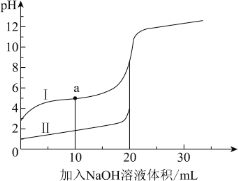
A.向 NaA 溶液中滴加 HB 可产生 HA
B.滴加 NaOH 溶液至 pH=7 时,两种溶液中 c(A-)=c(B-)
C.a 点,溶液中微粒浓度:c(A-) > c(Na+)
D.滴加 20 mL NaOH 溶液时,I 中 H2O 的电离程度大于 II 中
难度: 中等查看答案及解析
-
下列反应中,属于吸热反应的是
A.Na 与水反应 B.甲烷的燃烧反应
C.CaCO3 受热分解 D.锌与盐酸反应
难度: 简单查看答案及解析
-
下列各离子组在指定的溶液中能够大量共存的是
A.无色溶液中:Cu2+、K+、SCN−、Cl−
B.pH=11的NaOH 溶液中:CO
、Na+、NO
、SO
C.由水电离出的 c(H+)=1.0×10−13 mol·L−1 的溶液中:Na+、NH
、SO
、HCO
D.含有NO
的溶液中:I- 、SO
、SO
、H+
难度: 中等查看答案及解析
-
K2FeO4 在水中不稳定,发生反应:4FeO
+10H2O
4Fe(OH)3(胶体)+8OH- +3O2
,其稳定性与温度(T)和溶液 pH 的关系分别如图所示。下列说法正确的是
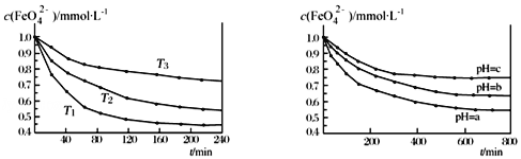
图 IK2FeO4 的稳定性与温度的关系 图 IIK2FeO4 的稳定性与溶液 pH 的关系
A.由图 I 可知 K2FeO4 的稳定性随温度的升高而升高 B.由图 II 可知图中 a>c
C.由图 I 可知温度:T1>T2>T3 D.由图 I 可知上述反应ΔH<0
难度: 中等查看答案及解析
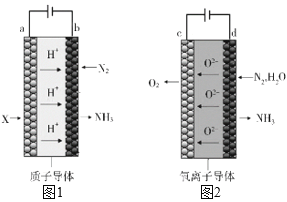

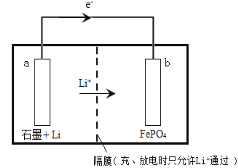
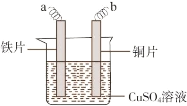
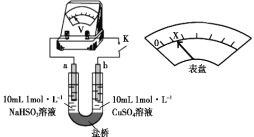
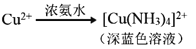 ;
;