-
化学与生活密切相关,下列说法正确的是( )
A.厨房中用的食盐、食醋都是电解质
B.95%的医用酒精溶液可用于环境消毒
C.硅胶和生石灰均可用作食品包装袋内的干燥剂
D.石英玻璃、普通玻璃、钢化玻璃都属于硅酸盐产品
难度: 简单查看答案及解析
-
下列有关化学用语的表达正确的是
A.氯离子的结构示意图
B.完全由非金属元素组成的化合物一定是共价化合物
C.H2S的电子式
D.次氯酸的结构式Cl-O-H
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的值。下列说法正确的是
A.NA个Fe(OH)3胶体粒子的质量为107 g
B.60 g的SiO2晶体中含有NA个SiO2分子
C.将1 mol NO和1 mol O2混合,充分反应后体系中原子总数为4NA
D.24 g Mg在空气中完全燃烧生成MgO和Mg3N2,转移的电子数大于2NA
难度: 简单查看答案及解析
-
下列反应的离子方程式书写正确的是
A.过氧化钠与水反应:2O22-+2H2O=4OH-+O2↑
B.向NaAlO2溶液中通入过量CO2:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-
C.向碳酸氢铵溶液中加入足量石灰水:Ca2++HCO3-+OH-=CaCO3↓+H2O
D.将CO2通入足量BaCl2溶液:CO2+H2O+Ba2+=BaCO3↓+2H+
难度: 中等查看答案及解析
-
NaClO溶液可以与金属Ag发生反应:4Ag+4NaClO+2H2O=4AgCl+4NaOH+O2↑,下列有关说法不正确的是
A.AgCl既是氧化产物又是还原产物
B.每生成1 mol O2,该反应共转移4 mol e-
C.由该反应可知,氧化性ClO->Ag+
D.每反应216 g Ag,被Ag还原的NaClO为1 mol
难度: 中等查看答案及解析
-
以下物质间的每步转化,存在不能通过一步反应实现的是( )
A.Cl2→HClO→HCl→NaCl B.Al2O3→NaAlO2→Al(OH)3→AlCl3
C.Fe→FeCl2→Fe(OH)2→Fe(OH)3 D.S→SO3→H2SO4→SO2
难度: 简单查看答案及解析
-
下列与实验有关的叙述不正确的是( )
A.粗盐可通过溶解、过滤、蒸发、结晶的方法提纯
B.取用金属钠或钾时,没用完的钠或钾要放回原瓶
C.焰色反应时,铂丝需用稀盐酸洗净,并在火焰上灼烧至无色
D.配制溶液定容时,俯视容量瓶的刻度线,则所配制溶液的浓度偏高
难度: 简单查看答案及解析
-
下列变化过程中,仅有共价键被破坏的是( )
A.晶体硅高温融化 B.干冰升华 C.NaCl溶于水 D.NH4Cl固体受热分解
难度: 简单查看答案及解析
-
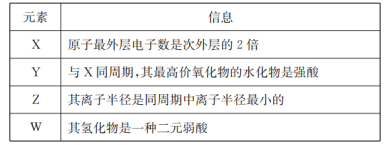
下图所示转化关系中A、B、C均为双原子气态单质,分别由短周期主族元素X、Y、Z组成。其中单质B含共用电子对数最多,甲和丙分子中均含有10个电子。下列说法正确的是( )
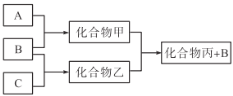
A.化合物乙是一种酸性氧化物 B.丙沸点比甲高,是因为丙的相对分子质量更大
C.原子半径大小关系X<Y<Z D.X、Y、Z三种元素形成的化合物不一定是强酸
难度: 简单查看答案及解析
-
反应Br+H2
HBr+H的能量变化如图所示,根据图像判断下列说法正确的是( )
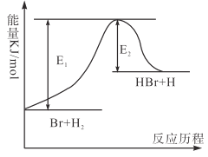
A.HBr的能量比H2的能量高
B.反应2C+O2=2CO的能量变化过程,与该图的变化过程相似
C.若该反应开始时加入催化剂,则反应达到平衡时吸收的能量增多
D.该反应中,H-H键断裂吸收的总能量大于H-Br键形成释放的总能量
难度: 简单查看答案及解析
-
下图装置中电流计指针偏转,且M棒变细,N棒变粗。由此判断表中所列M、N、P物质,与实验现象相符的是( )
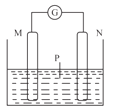
M
N
P
A
Al
Mg
NaOH溶液
B
Fe
Ag
AgNO3溶液
C
Zn
Cu
H2SO4溶液
D
Fe
Cu
浓硝酸
A.A B.B C.C D.D
难度: 简单查看答案及解析
-
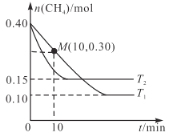
下列关于化学反应速率说法正确的是( )
A.对于A(s)+B(g)
2C(g)的反应,增加A的质量,反应速率加快
B.对于反应N2O5
2NO2+O2(正反应吸热),升高温度,v(正)减小,v(逆)增大
C.恒温恒容下反应2SO2(g)+O2(g)
2SO3(g),充入氦气不改变化学反应速率
D.1 mol·L-1稀盐酸与锌反应时,加入少量3 mol·L-1稀硝酸,生成H2的速率加快
难度: 简单查看答案及解析
-
在一绝热的恒容容器中,发生反应:X(s)+2Y(g)
M(g)+N(g),下列不能证明反应已达到平衡状态的是(注:绝热指不与外界发生热交换)
A.某一时刻v(Y)=2v(M) B.混合气体的密度不变
C.容器内温度不变 D.混合气体的平均相对分子质量不变
难度: 简单查看答案及解析
-
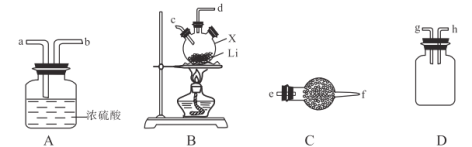
下列操作不能实现实验目的的是( )
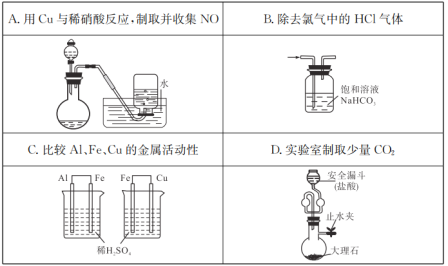
A.A B.B C.C D.D
难度: 简单查看答案及解析
-
镍氢电池是二次电池,充放电的总反应式是:Ni(OH)2+M
MH+NiO(OH),其中M为储氢合金。下列说法正确的是
A.放电时,MH在负极发生氧化反应
B.充电时,负极材料的质量变轻
C.放电时正极反应为NiO(OH)+H++e-=Ni(OH)2
D.该电池可以用稀硫酸作电解质溶液
难度: 中等查看答案及解析
-
向一定量的Fe、FeO和Fe2O3的混合物中加入4 mol/L的稀硝酸250 mL时,混合物恰好完全溶解并放出3.36 L NO气体(标准状况)。若用足量CO在加热下还原相同质量的该混合物,则反应掉的CO物质的量为( )
A.0.1 mol B.0.15 mol C.0.16 mol D.0.2 mol
难度: 中等查看答案及解析