-
甲烷(CH4)是一种温室气体,NO是常见大气污染物,为消除空气中少量的CH4和NO,工业上可以设计如下反应:CH4(g)+4NO(g) 2N2(g)+CO2(g)+2H2O(g),在温度为T1和T2时,分别将0.40 mol CH4和1.60 mol NO充入体积为2 L的恒容密闭容器中,n(CH4)随反应时间的变化如图所示:
2N2(g)+CO2(g)+2H2O(g),在温度为T1和T2时,分别将0.40 mol CH4和1.60 mol NO充入体积为2 L的恒容密闭容器中,n(CH4)随反应时间的变化如图所示:
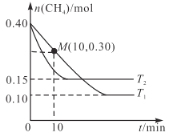
(1)根据上图判断该反应的T1________T2。(填“>”“<”或“=”)
(2)温度为T1,0~10 min内NO的平均反应速率v(NO)=___________,反应开始和平衡时容器的压强之比为___________。
(3)温度为T2,反应达到平衡时,NO的转化率为___________(保留3位有效数字)
(4)下列条件的改变不能加快反应速率的是___________。(填字母)
A.加入合适的催化剂 B.缩小容器体积
C.将CH4由0.4 mol改为0.8 mol D.分离出产物CO2
(5)CH4是重要的化石能源,完全燃烧生成CO2和H2O,放出大量热。若以熔融的K2CO3为电解质,可以设计成一种高温燃料电池,正极通入的气体是空气和CO2,负极反应式为:_______________________________________________________。
-
工业上消除氮氧化物的污染,可用如下反应:CH4(g)+2NO2(g) N2(g)+CO2(g)+2H2O(g) ΔH=a kJ/mol 在温度T1和T2时,分别将0.50 mol CH4和1.2 mol NO2充入体积为1 L的密闭容器中,测得n(CH4)随时间变化数据如下表:
N2(g)+CO2(g)+2H2O(g) ΔH=a kJ/mol 在温度T1和T2时,分别将0.50 mol CH4和1.2 mol NO2充入体积为1 L的密闭容器中,测得n(CH4)随时间变化数据如下表:
| 温度 | 时间/min n/mol | 0 | 10 | 20 | 40 | 50 |
| T1 | n(CH4) | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
| T2 | n(CH4) | 0.50 | 0.30 | 0.18 | …… | 0.15 |
下列说法不正确的是( )
A.10 min内,T1时CH4的化学反应速率比T2时小 B.温度:T1<T2
C.ΔH:a < 0 D.平衡常数:K(T1)<K(T2)
-
由A、B两种常见化合物按物质的量之比为1:2组成混合物,其相互关系如图.已知A、B的焰色反应均呈黄色,C、D为两种常见的对大气无污染性的无色气体,但D能导致“温室效应”,F遇硫氰化钾溶液呈红色.根据以上条件回答下列问题:
(1)E的化学式______ A的电子式______
(2)A物质与水反应的化学方程式______
(3)A、B按上述物质的量之比加热反应的化学方程式______ 4Na2CO3+O2↑+2H2O
-
(1)NO是污染大气的有毒气体.为了消除NO的污染,可将它与氨气在催化剂作用下反应,生成水和一种无污染的物质,该物质是空气的主要成分之一,该反应的化学方程式是________.
(2)汽车尾气产生的NO2可以在一定条件下和CO反应生成无毒物质,其反应方程式可表示为:2NO2+4CO═N2+4CO2,该反应的氧化剂是________,每生成1mol N2,反应中转移电子为________mol.
-
工业上消除氮氧化物的污染,可用如下反应:CH4(g)+2NO2(g)⇌N2(g)+CO2(g)+2H2O(g)△H=a kJ/mol;在温度T1和T2时,分别将0.50molCH4和1.2molNO2充入体积为1L的密闭容器中,测得n(CH4)随时间变化数据如下表:
| 温度 | 时间/min/mol | 0 | 10 | 20 | 40 | 50 |
| T1 | n(CH4) | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
| T2 | n(CH4) | 0.50 | 0.30 | 0.18 | … | 0.15 |
下列说法不正确的是
A.10min内, 时CH4的化学反应速率比T2时小
时CH4的化学反应速率比T2时小
B.T1<T2
C.平衡常数:K(T1)<K(T2)
D.a<0
-
CO和NO都是汽车尾气中的有害物质,它们之间能缓慢地发生如下反应:2NO(g)+2CO(g)  N2(g)+2CO2(g) ΔH<0,现利用此反应,拟设计一种环保装置,用来消除汽车尾气对大气的污染,下列设计方案可以最有效的提高尾气处理效果的是 ( )
N2(g)+2CO2(g) ΔH<0,现利用此反应,拟设计一种环保装置,用来消除汽车尾气对大气的污染,下列设计方案可以最有效的提高尾气处理效果的是 ( )
①选用适当的催化剂 ②提高装置温度 ③降低装置的压强 ④装置中放入碱石灰
A. ①④ B. ②④ C. ① D. ②③
-
下列推断正确的是
A. SiO2是酸性氧化物,能与NaOH溶液反应
B. Na2O、Na2O2组成元素相同,与CO2反应产物也相同
C. CO、NO、NO2都是大气污染物气体,在空气中都能温室存在
D. 新制氯水显酸性,向其中滴加少量紫色石蕊试液,充分震荡后溶液显红色
-
(10分)X、Y、Z、W是中学化学中常见的四种气体。已知:X、Y、Z三种气体都能对大气造成污染,在工业上都可以用碱液吸收;X是化石燃料燃烧的产物之一,是形成酸雨的物质;Y是一种单质,通常状况下是黄绿色,它的水溶液具有漂白作用;Z是硝酸工业和汽车尾气中的有害物质之一,能与水反应;W气体的水溶液滴入酚酞变红色。
请回答下列问题:
(1)X、Y两种气体按物质的量之比1:1在水溶液中能发生反应,化学方程式为 。
(2)科学家发现,Z在催化剂条件下能与W反应,反应产物中的单质应是(填化学式) ;该反应是氧化还原反应,则其中的氧化剂是(填化学式) 。
(3)在Z与水的反应中,氧化剂与还原剂的物质的量之比为 。
(4)检验W气体的方法是 。
-
X、Y、Z、W是中学化学中常见的四种气体。已知:X、Y、Z三种气体都能对大气造成污染,在工业上都可以用碱液吸收;X是化石燃料燃烧的产物之一,是形成酸雨的物质;Y是一种单质,它的水溶液具有漂白作用;Z是硝酸工业的汽车尾气中的有害物质之一,能与水反应;W气体的水溶液滴入酚酞变红色。
请回答下列问题:
(1)X、Y两种气体按物质的量之比1:1在水溶液中能发生反应,化学方程式为________;
(2)科学家发现,Z在催化剂条件下能与W反应生成无毒物质,化学方程式为________;其中的氧化剂是(填化学式)________。
(3)在Z与水的反应中,氧化剂与还原剂的物质的量之比为________。
(4)检验W气体的方法是________。
-
X、Y、Z、W是中学化学中常见的四种气体。已知:X、Y、Z三种气体都能对大气造成污染,在工业上都可以用碱液吸收;X是化石燃料燃烧的产物之一,是形成酸雨的物质;Y是一种单质,它的水溶液具有漂白作用;Z是硝酸工业的汽车尾气中的有害物质之一,能与水反应;W气体的水溶液滴入酚酞变红色。
请回答下列问题:
(1)X、Y两种气体按物质的量之比1:1在水溶液中能发生反应,化学方程式为_________________________________________________________;
(2)科学家发现,Z在催化剂条件下能与W反应,反应产物中的单质应是(填化学式)_____________________;该反应是氧化还原反应,则其中的氧化剂是(填化学式)__________________________________________________。
(3)在Z与水的反应中,氧化剂与还原剂的物质的量之比为__________________________________
2N2(g)+CO2(g)+2H2O(g),在温度为T1和T2时,分别将0.40 mol CH4和1.60 mol NO充入体积为2 L的恒容密闭容器中,n(CH4)随反应时间的变化如图所示:
