-
下列实验现象与实验操作不相匹配的是( )
选项
实验操作
实验现象
A
在Fe(NO3)2溶液中滴加酸化的H2O2
浅绿色变黄色
B
将金属钠在燃烧匙中点燃,迅速伸入集满CO2的集气瓶
集气瓶中产生大量白烟,瓶内有黑色颗粒产生
C
向盛有硝酸银溶液的试管中
逐渐滴入浓氨水
产生白色沉淀,且白色沉淀不溶解
D
向盛Na2SO3溶液的试管中滴加1滴酚酞,然后逐滴加入稀盐酸至过量
试管中溶液先变红后褪色
A.A B.B C.C D.D
难度: 简单查看答案及解析
-
“白墙黑瓦青石板,烟雨小巷油纸伞”是著名诗人戴望舒的著名诗句,下列有关说法中错误的是
A.“白墙”的白色源于墙体表层的CaCO3
B.“青石板”与“黑瓦”的主要成分都是硅酸盐
C.纸和伞骨架的竹子主要成分是纤维素
D.伞面上的熟桐油是天然植物油,具有防水作用
难度: 简单查看答案及解析
-
下列说法正确的是
A.环戊二烯(
)分子中所有原子共平面
B.同主族元素含氧酸的酸性随核电荷数的增加而减弱
C.二甲醚易溶于水,氨基乙酸的熔点较高,主要原因都与氢键有关
D.1-二环丙基乙烯(
)的二氯代物共有(不含立体异构)9种
难度: 中等查看答案及解析
-
NA是阿伏加德罗常数的值,下列说法正确的是( )
A.7.8g苯含σ键的数目为0.6NA
B.将Cl2通入FeBr2溶液中,有1molBr2生成时,转移的电子数为2NA
C.1molNH4NO3完全溶于稀氨水中,溶液呈中性,溶液中NH
的数目为NA
D.有铁粉参加的反应若生成3molFe2+,则转移电子数一定为6NA
难度: 中等查看答案及解析
-
《梦溪笔谈》有记:馆阁新书净本有误书处,以雌黄涂之。在中国古代,雌黄(As2S3)经常用来修改错字,其结构如图所示。下列说法不正确的是( )
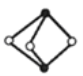
A.As、S原子的杂化方式均为sp3
B.AsH3的沸点比NH3的低
C.与As同周期且基态原子核外未成对电子数目相同的元素只有V
D.已知As2F2分子中各原子均满足8电子结构,分子中σ键和π键的个数比为3:1
难度: 中等查看答案及解析
-
化合物Y是一种常用药物,可由X制得。下列有关化合物X、Y的说法正确的是( )
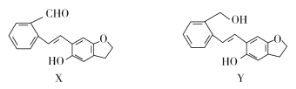
A.化合物X、Y均易被氧化
B.1molY最多可与2molNaOH发生反应
C.由X转化为Y发生取代反应
D.X与足量H2发生反应后,生成的分子中含有5个手性碳原子
难度: 简单查看答案及解析
-
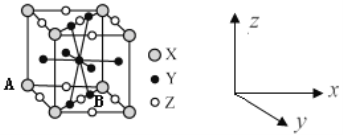
短周期主族元素X、Y、Z、W原子序数依次增大,A、B、C、D、E为其中两种元素组成的常见化合物,基态Z原子核外有两个未成对电子,A、D均含有10个电子且中心原子的杂化方式相同,它们之间的转化关系如图所示(部分反应物或生成物省略),下列说法中不正确的是( )
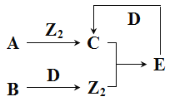
A.简单离子半径:Y>Z>W
B.若C中混有E可用水洗方法除去
C.每个D分子周围可以形成4个氢键
D.B与D反应生成Z2时,D作还原剂
难度: 中等查看答案及解析
-
由硫铁矿烧渣(主要成分:Fe3O4、Fe2O3和FeO)得到绿矾(FeSO4·7H2O),再通过绿矾制备铁黄[FeO(OH)]的流程如下:烧渣
溶液
绿矾
铁黄。已知:FeS2和铁黄均难溶于水。下列说法不正确的是( )
A.步骤①,最好用硫酸来溶解烧渣
B.步骤②,涉及的离子反应为FeS2+14Fe3++8H2O═15Fe2++2SO42−+16H+
C.步骤③,将溶液加热到有较多固体析出,再用余热将液体蒸干,可得纯净绿矾
D.步骤④,反应条件控制不当会使铁黄中混有Fe(OH)3
难度: 中等查看答案及解析
-
中国科学院深圳研究院成功研发出一种基于二硫化钼/碳纳米复合材料的钠型双离子电池,可充放电。其放电时工作原理如图所示。下列说法不正确的是( )
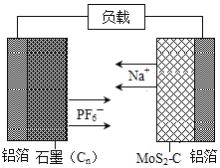
A.二硫化钼/碳纳米复合材料为该电池的负极材料
B.放电时正极的反应式为Cn(PF6)x+xe-═xPF6-+Cn
C.充电时阴极的电极反应式为MoS2-C+xNa++xe-=NaxMoS2-C
D.充电时石墨端铝箔连接外接电源的负极
难度: 中等查看答案及解析
-
工业上除去电石渣浆(含CaO)上清液中的S2-,并制取石膏(CaSO4∙2H2O)的常用流程如图:
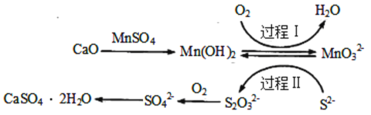
下列说法不正确的是( )
A.过程Ⅰ、Ⅱ中起催化剂作用的物质是Mn(OH)2
B.常温下,56gCaO溶于水配成1L溶液,溶液中Ca2+的数目为6.02×1023个
C.将10L上清液中的S2-转化为SO
(S2-浓度为320mg·L-1),理论上共需要0.2mol的O2
D.过程Ⅱ中,反应的离子方程式为4MnO
+2S2-+9H2O=S2O
+4Mn(OH)2↓+10OH-
难度: 中等查看答案及解析
-
工业上常采用“电催化氧化—化学沉淀法”对化学镀镍废水进行处理,电解过程中电解槽中H2O、Cl-放电产生·OH、HClO,在活性组分作用下,阴阳两极区发生的反应如下(R表示有机物):
①R+·OH→CO2+H2O
②R+HClO→CO2+H2O+Cl-
③H2PO
+2·OH-4e-=PO
+4H+
④HPO
+·OH-2e-=PO
+2H+
⑤H2PO
+2ClO-=PO
+2H++2Cl-
⑥HPO
+ClO-=PO
+H++Cl-
⑦Ni2++2e-=Ni
⑧2H++2e-=H2↑
下列说法不正确的是( )
A.·OH、HClO在阳极上产生
B.增大电极电压,电化学氧化速率加快
C.电解时,阴极附近pH逐渐升高,Ni2+去除率逐渐减小
D.向电解后的废水中加入CaCl2可以去除磷元素
难度: 中等查看答案及解析
-
某温度时硫酸盐MSO4(M:Pb2+、Ba2+、Sr2+)的沉淀溶解平衡曲线如图所示。已知p(M)=-lgc(M),p(SO42-)=-lgc(SO42-)。下列说法正确的是
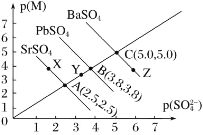
A.向BaSO4悬浊液中加入浓度较大的Pb(NO3)2溶液可能转化成PbSO4
B.X、Y两点对应的SrSO4均是饱和溶液,不能继续溶解SrSO4
C.蒸发Z点的BaSO4溶液可得到C点状态的BaSO4溶液
D.溶度积:Ksp(SrSO4)<Ksp(PbSO4)<Ksp(BaSO4)
难度: 困难查看答案及解析

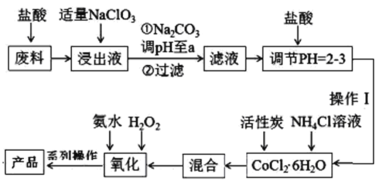
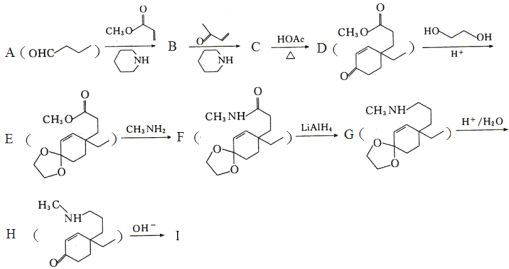
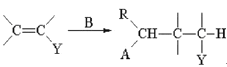 (A,Y可以是CHO、C=O、COOR等;B可以是OH—、CH3CH2O—、
(A,Y可以是CHO、C=O、COOR等;B可以是OH—、CH3CH2O—、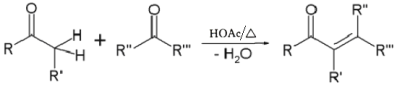
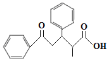 的合成路线___(其它试剂任选)
的合成路线___(其它试剂任选)