-
邮票被誉为国家名片,是我国化学史不可或缺的重要文献,下列说法错误的是( )

A.邮票甲中的人物是侯德榜,创立了中国人自己的制碱工艺—侯氏制碱法
B.邮票乙中的图是用橡胶生产的机动车轮胎,塑料、橡胶和纤维被称为三大合成材料
C.邮票丙中的图是显微镜下的结晶牛胰岛素,我国首次合成的结晶牛胰岛素属于蛋白质
D.邮票丁是纪念抗击非典的邮票,非典和新型冠状病毒都可用紫外线、高温等杀死
难度: 简单查看答案及解析
-
GMA可用作涂料、离子交换树脂和油墨的黏合剂等,通过酯交换反应制备,反应如下:
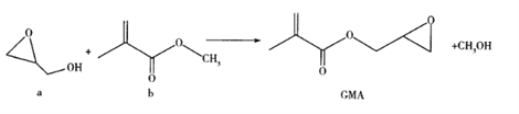
下列说法错误的是( )
A.与a互为同分异构体的羧酸只有1种
B.b分子中的所有C原子和O原子可能在同一平面内,含有三种官能团
C.GMA的分子式为C7H10O3
D.GMA能与NaOH溶液、溴水、酸性KMnO4溶液反应
难度: 简单查看答案及解析
-
短周期主族元素W、X、Y、Z原子序数依次增大,并且位于三个不同的周期,W与Y同主族,X与Z的核外电子数之和是Y的核外电子数的2倍。化合物甲的结构如图所示,甲不溶于水,下列说法正确的是( )
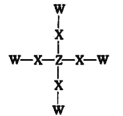
A.元素Z在自然界中既有游离态又有化合态
B.化合物甲中每个原子都满足8电子结构
C.W和Y形成二元化合物的熔点高于W和X形成二元化合物的熔点
D.元素的非金属性:Z>X>W>Y
难度: 中等查看答案及解析
-
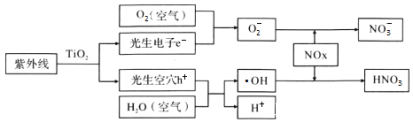
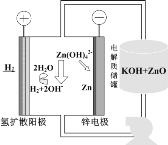
利用如图装置从含NH4H2PO4和(NH4)2HPO4的废水中回收NH3·H2O和H3PO4,下列说法错误的是( )
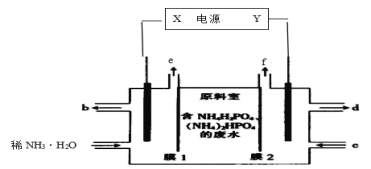
A.电源中X和Y两电极的电势X比Y低
B.膜1为阳离子交换膜,f口放出的是O2
C.阳极区反应之一为:2H2O-4e-+2HPO
=O2↑+2H3PO4
D.每放出11.2L(标准状况下)H2时,能回收98gH3PO4
难度: 中等查看答案及解析
-
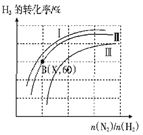
25℃时,改变0.1mol·L-1弱酸RCOOH溶液的pH,溶液中RCOOH分子的物质的量分数δ(RCOOH)随之改变[已知δ(RCOOH)=
],0.1mol·L-1甲酸(HCOOH)与0.1mol·L-1丙酸(CH3CH2COOH)溶液中δ(RCOOH)与pH的关系如图所示。下列说法正确的是(已知酸性:甲酸>丙酸)( )
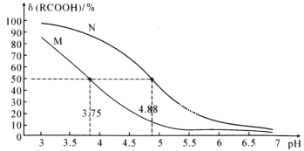
A.图中M线对应的是丙酸,N线对应的甲酸
B.CH3CH2COONa的水解平衡常数Kh=10-10.25
C.等浓度的HCOONa和CH3CH2COONa两种溶液中:c(HCOO-)+c(OH-)>c(CH3CH2COO-)+c(OH-)
D.将0.1mol/L的HCOOH溶液与0.1mol/L的HCOONa溶液等体积混合,所得溶液中:c(Na+)>c(HCOOH)>c(HCOO-)>c(OH-)>c(H+)
难度: 中等查看答案及解析
-
下列实验操作可以达到实验目的的是( )
选项
实验目的
实验操作
A
探究浓度对反应速率的影响
向2支各盛有4mL0.01mol·L-1KMnO4酸性溶液的试管中,分别加入2mL0.1mol·L-1H2C2O4溶液和2mL0.2mol·L-1H2C2O4溶液,记录溶液褪色所需的时间
B
配制1.00mol·L-1的NaOH溶液
称取4.0g固体NaOH于烧杯中,加入少量蒸馏水溶解,然后转移至100mL容量瓶中定容
C
探究固体表面积对反应速率的影响
称取相同质量的大理石和纯碱,加入到盛有浓度、体积均相同的盐酸的小烧杯中,观察实验现象
D
探究淀粉溶液在稀硫酸和加热条件下是否水解
取少量的水解液于试管中,先加适量的NaOH溶液,再滴入碘水,观察实验现象
A.A B.B C.C D.D
难度: 中等查看答案及解析