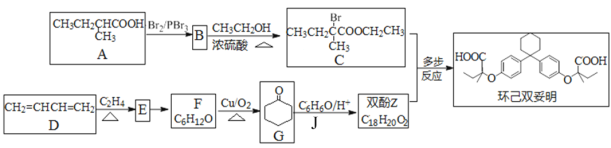
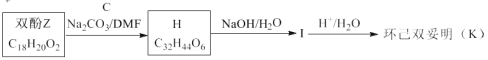-
下列垃圾分类不合理的是




A.果皮、果核
B.废弃口罩
C.充电电池
D.灰土、瓷片
A.A B.B C.C D.D
难度: 简单查看答案及解析
-
下列化学用语正确的是
A.乙烯的比例模型:
 B.氯仿电子式:
B.氯仿电子式:C.醋酸电离:CH3COOH= CH3COO-+ H+ D.钢铁吸氧腐蚀的负极反应:Fe – 3e-=Fe3+
难度: 简单查看答案及解析
-
糖类、油脂、蛋白质是重要的营养物质,下列说法正确的是
A.棉、麻、蚕丝都是纤维素 B.油脂的皂化反应属于取代反应
C.1 mol 蔗糖完全水解可得 2 mol 葡萄糖 D.遇 Pb2+凝固后的鸡蛋清可溶于蒸馏水
难度: 中等查看答案及解析
-
某铁的氧化物(FexO)1.52g溶于足量盐酸中,向所得溶液中通入标准状况下112mlCl2,恰好将Fe2+完全氧化。x值为( )
A. 0.80 B. 0.85 C. 0.90 D. 0.93
难度: 中等查看答案及解析
-
设 NA 为阿伏加德罗常数值。下图表示 N2O 在Pt2O+表面与 CO 反应转化成无害气体的过程。下列说法正确的是
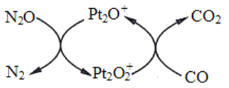
A.N2O 转化成无害气体时的催化剂是
B.1g N2O 气体中含有电子数为 0.5NA
C.1mol CO2 中含有 2NA 个共用电子对 D.1mol Pt2O+转化为
得电子数为 3NA
难度: 中等查看答案及解析
-
X、Y、W、Z 是四种常见短周期元素,其原子半径随原子序数变化如图所示。已知 W的一种核素的质量数为 18,中子数为 10,X 和Ne 原子的核外电子总数相差 1;Y 的单质是一种常见的半导体材料;Z 的非金属性在同周期主族元素中最强。下列说法正确的是
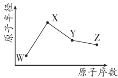
A.最高化合价:X>Y>Z>W
B.简单气态氢化物的稳定性:Y>W
C.Y 的氧化物与 X、Z 的最高价氧化物对应的水化物均能反应
D.由 X、Z、W 三种元素形成的化合物一定既含有离子键又含有共价键
难度: 中等查看答案及解析
-
下列现象及解释不正确的是
A.水晶手镯接触石灰水会被腐蚀:SiO2+Ca(OH)2== CaSiO3+H2O
B.不用铝盆盛放食醋:2Al+6CH3COOH==2Al (CH3COO)3+3H2↑
C.石灰水和过量小苏打溶液混合会变浑浊:
+ Ca2++OH- == CaCO3↓+ H2O
D.AgNO3 溶液滴入过量浓氨水中不会出现沉淀:Ag+ +2NH3∙ H2O ==
+ 2H2O
难度: 中等查看答案及解析
-
某科研人员提出HCHO(甲醛)与O2在羟基磷灰石(HAP)表面催化生成H2O的历程,该历程示意图如下(图中只画出了 HAP的部分结构):

下列说法不正确的是
A. HAP能提高HCHO与O2的反应速率
B. HCHO在反应过程中,有C-H键发生断裂
C. 根据图示信息,CO2分子中的氧原子全部来自O2
D. 该反应可表示为:HCHO+O2
CO2+H2O
难度: 中等查看答案及解析
-
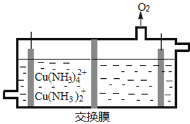
氢氧熔融碳酸盐燃料电池是一种高温电池(600~700℃),具有效率高、噪音低、无污染、燃料多样、余热利用价值高等优点。氢氧熔融碳酸盐燃料电池的工作原理如图所示。下列有关该电池的说法正确的是
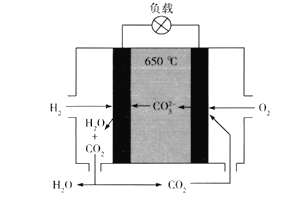
A.电池工作时,熔融碳酸盐只起到导电的作用
B.负极反应式为H2 -2e- +CO32-==CO2+H2O
C.该电池可利用工厂中排出的CO2,减少温室气体的排放
D.电池工作时,外电路中流过0.2 mol电子,消耗3.2 g O2
难度: 中等查看答案及解析
-
下列实验现象预测正确的是
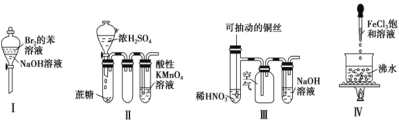
① 实验Ⅰ:振荡后静置,上层溶液颜色保持不变
② 实验Ⅱ:酸性 KMnO4 溶液中出现气泡,且颜色逐渐褪去
③ 实验Ⅲ:微热稀 HNO3 片刻,溶液中有气泡产生,广口瓶内始终保持无色
④ 实验Ⅳ:继续煮沸溶液至红褐色,停止加热,当光束通过体系时可产生丁达尔效应
A.①② B.③④ C.①③ D.②④
难度: 中等查看答案及解析
-
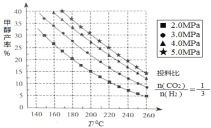
已知 443℃时: 2HI(g)⇌H2(g) +I2(g) ΔH = +12.5 kJ·mol-1 ,443℃时,向 1L 密闭容器中充入 1 mol HI,体系中 c(HI)与反应时间 t 的关系如下图所示。下列说法中,正确的是

A.反应进行 40 min 时,体系吸收的热量约为 0.9375 kJ
B.升高温度,再次平衡时,c(HI) > 0.78 mol·L-1
C.0~20 min 内的平均反应速率可表示为υ(H2) = 0.0045 mol·L-1·min-1
D.该反应的化学平衡常数计算式为
难度: 中等查看答案及解析
-
从海水中制备纯碱和金属镁的流程如下图所示:
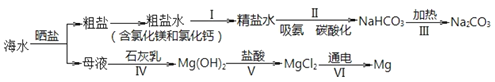
下列说法不正确的是
A.流程 I 依次向粗盐水中加入过量 Ca(OH)2 溶液、Na2CO3 溶液并过滤
B.流程 II 吸氨是使溶液呈碱性,有利于吸收二氧化碳
C.海水提镁流程中涉及到三种基本反应类型
D.流程 IV、V 是通过化学方法富集镁元素
难度: 中等查看答案及解析
-
25℃时,向 10mL 0.01 mol/L NaCN 溶液中逐滴滴加 10mL0.01 mol/L 的盐酸,其 pH 变化曲线如图所示。下列溶液中的关系一定正确的是(忽略体积微小变化)
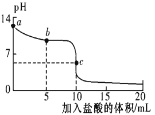
A.a 点溶液的 pH ≥12
B.b 点的溶液:c(CN-)> c(Cl-)>c(HCN )
C.pH =7 的溶液:c(Na+)+ c(H+) =c(Cl-)+ c(CN-)
D.c 点的溶液:c(CN-)+c(HCN ) +c(Cl-)=0.01 mol/L
难度: 中等查看答案及解析
-
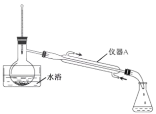
探究补铁剂[主要成分:氯化血红素(含+2 价铁)、富锌蛋白粉、维生素 C、乳酸、葡萄糖浆] 中铁元素是否变质。先取少量补铁剂,用酸性丙酮溶解后制成溶液。
实验Ⅰ
实验Ⅱ
实验Ⅲ
取待测液,加入少量 KSCN 溶液,无明显现象;再加入少量H2O2,溶液不变红
取实验Ⅰ所得溶液,再加入少量KSCN 溶液,无明显现象;再加入H2O2溶液,溶液变为红褐色
取实验Ⅰ所得溶液,加入少量盐酸溶液,无明显现象,继续加入H2O2 至过量,溶液先变红后褪色
下列说法不正确的是
A.实验Ⅰ中加入KSCN 溶液无明显现象,与 KSCN 溶液的用量无关
B.实验Ⅰ中加入H2O2溶液后不变红,可能是H2O2被维生素 C 还原了
C.实验Ⅲ中溶液红色褪去,可能是H2O2将SCN-氧化了
D.实验说明,该补铁剂中+2 价铁在酸性条件下才能被H2O2氧化
难度: 中等查看答案及解析