-
氯化亚铜是有机合成工业中应用较广的催化剂。
(1)CuCl用作制备碳酸二甲酯的催化剂:4CH3OH+2CO+O2 2(CH3O)2CO+2H2O,请填写化学方程式将催化原理补充完整:i.4CuCl+4CH3OH+O2=4Cu(CH3O)Cl+2H2O;ii.________________________。
2(CH3O)2CO+2H2O,请填写化学方程式将催化原理补充完整:i.4CuCl+4CH3OH+O2=4Cu(CH3O)Cl+2H2O;ii.________________________。
(2)一种用废铜制备氯化亚铜的过程如下:
Cu(s)+Cl2(g)=CuCl2(s) △H=-a kJ·mol-1
CuCl2(s) +Cu(s) +4HCl(aq)=2H2[CuCl3] (aq) △H=+b kJ·mol-1
CuCl(s) + 2HCl(aq)⇌H2[CuCl3] (aq) △H=-c kJ·mol-1
①反应 2Cu(s)+Cl2(g)=2CuCl(s) △H=_______________ kJ·mol-1(用含 a、b、c 的式子表示)
②向CuCl2 溶液中加入过量铜粉,发生反应生成CuC1。但在实验过程中要加入浓盐酸反应才能持续进行,反应结束后将溶液倒入蒸馏水中稀释获得CuCl。加入浓盐酸的目的是___________________。
(3)在电解槽中电解氨性含铜蚀刻废液,电解后向阴极液中加入盐酸酸化,再倒入蒸馏水稀释,得到氯化亚铜沉淀。
①电解装置如图所示,阴极区电极方程式为___________________________ 。
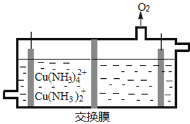
②稀释过程中溶液的温度不同,得到沉淀质量和氯化亚铜百分含量变化如图所示。
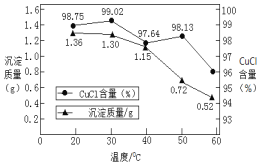
从氯化亚铜产率角度分析,最佳稀释温度为__________________;温度越高得到氯化亚铜沉淀质量越小,其原因可能是:i.加热过程中部分氯化亚铜被氧化;ii.___________________。
-
氯化亚铜(CuCl)为白色粉末,微溶于水。常用作有机合成催化剂,并用于颜料、防腐等工业。实验室可采用亚硫酸钠还原氯化铜的方法制备氯化亚铜,主要流程如图所示:
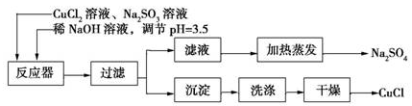
(1)上述方法制备氯化亚铜的化学方程式为_________________ 。
。
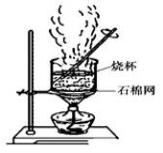
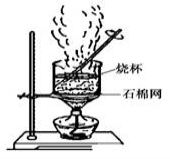
(2)下图是加热蒸发滤液,回收Na2SO4的装置。装置图中存在一处严重错误,该错误是_____________。
(3)洗涤产品氯化亚铜沉淀的试剂是___________,检验沉淀是否洗涤干净的方法是_______________。
(4)CuCl的盐酸溶液能吸收 一氧化碳而生成氯化羰基亚铜[Cu2Cl2(CO)2·2H2O]。下图是用CO(含有CO2杂质)还原CuO并验证其氧化产物的实验装置图。
一氧化碳而生成氯化羰基亚铜[Cu2Cl2(CO)2·2H2O]。下图是用CO(含有CO2杂质)还原CuO并验证其氧化产物的实验装置图。
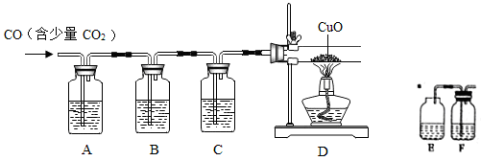
装置A中盛装的是饱和NaOH溶液,该装置的作用是_____________,装置B盛有澄清的石灰水,其中装置B的作用是___________,盛装CuCl的盐酸溶液的装置是____________(选填装置中提供的装置字母代号)。
-
氯化亚铜(CuCl)为白色粉末,微溶于水。常用作有机合成催化剂,并用于颜料、防腐等工业。实验室可采用亚硫酸钠还原氯化铜的方法制备氯化亚铜,主要流程如图所示:
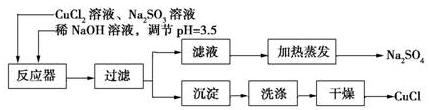
(1)上述方法制备氯化亚铜的化学方程式为_________________。
(2)下图是加热蒸发滤液,回收Na2SO4的装置。装置图中存在一处严重错误,该错误是_____________。
(3)洗涤产品氯化亚铜沉淀的试剂是____________,检验沉淀是否洗涤干净的方法是_______________。
(4)CuCl的盐酸溶液能吸收一氧化碳而生成氯化羰基亚铜[Cu2Cl2(CO)2·2H2O]。下图是用CO(含有CO2杂质)还原CuO并验证其氧化产物的实验装置图。

装置A中盛装的是饱和NaOH溶液,该装置的作用是______________,装置B盛有澄清的石灰水,其中装置B的作用是_____________,盛装CuCl的盐酸溶液的装置是__________(选填装置中提供的装置字母代号)。
-
氯化亚铜(CuCl)常用作有机合成工业中的催化剂,是一种白色粉末;微溶于水、不溶于乙醇及稀硫酸。工业用如下流程,从酸性废液(主要含Cu2+、Fe3+、 H+、Cl-)中制备氯化亚铜。

请回答下列问题:
(1)写出步骤①中发生的两个主要反应的离子方程式:_________________________。
(2)步骤②的操作名称是:_____________。
(3)步骤④中所加物质X为:__________。
(4)步骤⑤的操作是:___________________________________________________。
(5)步骤⑥应调节溶液pH呈酸性,且用乙醇洗涤CuCl晶体,目的是:______________。
(6)在CuCl的生成过程中,可以循环利用的物质是______________,理论上_____(填“是”或“否”)需要补充(不考虑调节等消耗);理由是__________________________________。
(7)工业上还可以采用以碳棒为电极电解CuCl2溶液得到CuCl。写出电解CuCl2溶液中的阴极上发生的电极反应 ___________________________________________。
-
氯化亚铜(CuCl)常用作有机合成工业中的催化剂,是一种白色粉末;微溶于水、不溶于乙醇及稀硫酸。工业上采用如下工艺流程,从某酸性废液(主要含Cu2+、Fe3+、 H+、Cl-)中制备氯化亚铜。

请回答下列问题:
(1)写出步骤①中发生的两个主要反应的离子方程式(2分): 。
(2)操作②的名称是: ,步骤④中所加物质X为: 。
(3)步骤⑥应调节溶液pH呈酸性,且用乙醇洗涤CuCl晶体,目的是: 。
-
氯化亚铜(CuCl)常用作有机合成工业中的催化剂,是一种白色粉末;微溶于水、不溶于乙醇及稀硫酸。工业上采用如下工艺流程,从某酸性废液(主要含Cu2+、Fe3+、 H+、Cl-)中制备氯化亚铜。
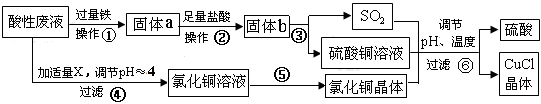
请回答下列问题:(1)写出步骤①中发生的两个主要反应的离子方程式: 。
(2)步骤②的操作名称是: 。
(3)步骤④中所加物质X为: 。
(4)步骤⑤的操作是: 。
(5)步骤⑥应调节溶液pH呈酸性,且用乙醇洗涤CuCl晶体,目的是: 。
(6)在CuCl的生成过程中,可以循环利用的物质是__________,理论上_______(填“是”或“否”)需要补充(不考虑调节等消耗);理由是 。
(7)工业上还可以采用以碳棒为电极电解CuCl2溶液得到CuCl。写出电解CuCl2溶液中的阴极上发生的电极反应 。
-
氯化亚铜(CuCl)常用作有机合成工业中的催化剂,是一种白色粉末;微溶于水、不溶于乙醇及稀硫酸。工业上采用如下工艺流程,从某酸性废液(主要含Cu2+、Fe3+、H+、Cl-中制备氯化亚铜。

请回答下列问题:
(1)出步驟①中发生的两个主要反应的离子方程式:___。
(2)步骤②的操作名称是____。
(3)步骤④中所加物质X为_____。
(4)步骤⑤的操作是_____。
(5)步骤⑥应调节溶液pH呈酸性,且用乙醇洗涤CuCl晶体,目的是____。
(6)在CuCl的生成过程中,可以循环利用的物质是____。
-
氯化亚铜(CuCl)常用作有机合成工业中的催化剂,是一种白色粉末,微溶于水不溶于乙醇及稀硫酸。工业上采用如下工艺流程,从菜酿性废液( 主要會Cu2+、Fe3+、H+、Cl-)中 制备氯化亚 铜。

(1)操作①②的名称是_________________。
(2)写出加入过量X发生化合反应的离子方程式:____________________。
(3)生成蚀刻液的离子方程式是式:____________________。
(5)写出生成CuCl的化学方程式式:____________________。298K 时, Ksp.(CuCl)=1.2×10-6,要使Cu+沉淀完全,则容液中(Cl- )至少为__________________。洗涤CuCl晶体所用的试剂为____(填序号)。
A.饱和Na2CO3溶液 B.NaOH 溶液 C.无水乙醇 D.四氯化碳
(5)准确称取所制得的0.250gCuCl样品置于一定量的0.5mol/LFeCl3溶液中,待样品完全溶解后,加水20mL,用0.10 0mol/L 的Ce(SO4)2溶液滴定到终点,消耗22. 60mLCe(SO4)2溶液。已知有关反应的离子方程式为Fe3++CuCl=Fe2++ Cu2++Cl-,Ce4++Fe2+=Fe3++Ce3+;国家标准规定合格的CuCl产品的主要质量指标为CuCl的质量分数大于96.50%。试通过计算说明上述样品是否符合国家标准。_____________________
-
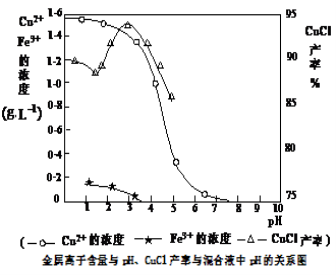
(16分)氯化亚铜(CuCl)是有机合成工业中应用较广泛的催化剂,它是白色粉末,微溶于水,不溶于乙醇,在空气中会被迅速氧化。从酸性电镀废液(主要含Cu2+、Fe3+)中制备氯化亚铜的工艺流程如下:
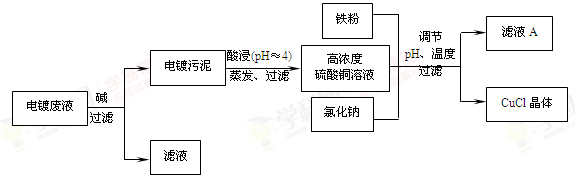
请回答下列问题:
(1)电镀污泥的主要成分是 (写化学式)。
(2)铁粉、氯化钠、硫酸铜在溶液中反应生成CuCl的离子反应方程式为:
。
(3)析出CuCl晶体时的最佳pH在 左右。
(4)析出的CuCl晶体要立即用无水乙醇洗涤,然后真空干燥、冷却,密封包装。真空干燥,密封包装的目的是 。
(5)从滤液A中可回收的主要物质是 (写化学式)。
(6)以碳棒为电极电解CuCl2溶液可得到CuCl。写出电解CuCl2溶液后的阴极上发生的反应为
-
(15分)氯化亚铜(CuCl)是有机合成工业中应用较广泛的催化剂,它是白色粉末,微溶于水,不溶于乙醇,在空气中会被迅速氧化。从酸性电镀废液(主要含Cu2+、Fe3+)中制备氯化亚铜的工艺流程图如下:
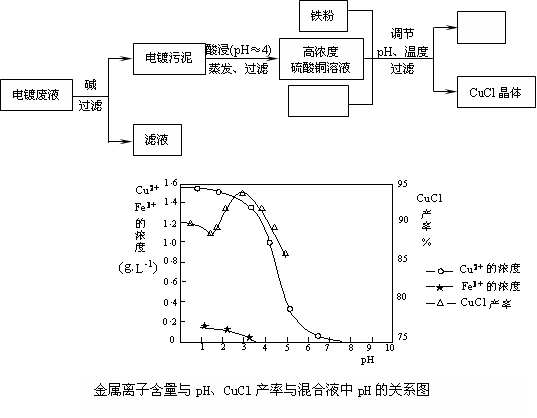
请回答下列问题:
(1)电镀污泥的主要成分是________(写化学式);
(2)酸浸时发生反应的离子方程式是________;
(3)析出CuCl晶体时的最佳pH在________左右;
(4)铁粉、氯化钠、硫酸铜在溶液中反应生成CuCl的离子反应方程式为:
________;
(5)析出的CuCl晶体要立即用无水乙醇洗涤,然后真空干燥、冷却,密封包装。真空干燥,密封包装的目的是________。
2(CH3O)2CO+2H2O,请填写化学方程式将催化原理补充完整:i.4CuCl+4CH3OH+O2=4Cu(CH3O)Cl+2H2O;ii.________________________。















