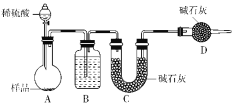
-
钠及其化合物的下列用途与化学性质有关的是
A.制焰火 B.作原子反应堆的导热剂
C.冶炼金属钛 D.应用于电光源
难度: 简单查看答案及解析
-
事实上,许多非金属氧化物在一定条件下能与Na2O2反应,且反应极有规律,如Na2O2+SO2═Na2SO4 , 2Na2O2+2SO3═2Na2SO4+O2据此,你认为下列反应方程式中正确的是
A.2Na2O2+2N2O4═4NaNO3 B.Na2O2+2NO2═2NaNO2+O2
C.2Na2O2+2N2O3═4NaNO2+O2 D.2Na2O2+2 Mn2O7═4Na2MnO4+O2
难度: 中等查看答案及解析
-
下列说法中正确的是
A.Na2O2遇到湿润的紫色石蕊试纸后,石蕊试纸最终变成蓝色
B.Na2O2与CO2反应生成0.1molO2时转移电子0.4mol
C.向饱和烧碱溶液中加入2gNa2O2充分反应完时,溶液中c(Na+)不变
D.将Na2O2投入CuCl2溶液中有蓝色沉淀及气泡产生
难度: 简单查看答案及解析
-
为了使宇航员在飞船中得到一个稳定的、良好的生存环境,一般在飞船内安装盛有Na2O2或K2O2颗粒的装置,它的用途是产生氧气。下列关于Na2O2的叙述正确的是
A.Na2O2久置于空气中会变成NaOH白色固体
B.Na2O2分别与水及CO2反应产生相同量的O2时,需要水和CO2的质量相等
C.Na2O2分别与水及CO2反应产生相同量的O2时,转移电子的物质的量相等
D.Na2O2的漂白原理与SO2的漂白原理相同
难度: 中等查看答案及解析
-
在溶液中加入足量的Na2O2后仍能大量共存的离子组是
A.Na+、Fe2+、Cl-、
- B.K+、
、Cl-、
C.Ca2+、Mg2+、
、
D.Na+、Cl-、
、
难度: 中等查看答案及解析
-
往FeCl3和BaCl2的混合溶液中通入SO2,溶液颜色由棕黄色变成浅绿色,同时有白色沉淀产生,下列说法正确的是
A.该实验表明FeCl3有还原性 B.白色沉淀为BaSO3
C.该实验表明SO2有漂白性 D.反应后溶液酸性增强
难度: 中等查看答案及解析
-
一定温度下,mg下列物质在足量的氧气中充分燃烧后,产物与足量的过氧化钠充分反应,过氧化钠增加了ng,且n>m,符合此要求的物质是( )
①H2 ②CO ③CO和H2的混合物 ④HCOOCH3⑤CH3CHO
A.⑤ B.①② C.①②③④ D.①②③④⑤
难度: 中等查看答案及解析
-
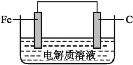
下列关于Fe3+、Fe2+性质实验的说法错误的是( )
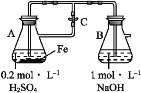
A.用如图装置可以制备Fe(OH)2沉淀
B.配制FeCl3溶液时,先将氯化铁晶体溶于较浓的盐酸中,再加水稀释到所需要的浓度
C.向某溶液中滴加KSCN溶液,溶液不变色,滴加氯水后溶液显红色,此现象不能确定溶液中含有Fe2+
D.向FeCl2溶液中加入少量铁粉是为了防止Fe2+被氧化
难度: 中等查看答案及解析
-
下列事实及其解释不正确的是
A.钠保存在煤油中,是因为煤油不与钠发生反应,钠比煤油密度大,煤油可以使钠隔绝空气和水蒸气
B.滴有酚酞的NaHCO3溶液呈浅红色,微热后红色加深,是因为NaHCO3分解生成了Na2CO3
C.用洁净的玻璃管向包有Na2O2的脱脂棉吹气,脱脂棉燃烧,说明CO2、H2O与Na2O2的反应是放热反应
D.钠长期暴露在空气中的产物是Na2CO3,原因是钠与氧气生成的Na2O与水和二氧化碳反应
难度: 简单查看答案及解析
-
用如图所示实验装置进行相关实验探究,其中装置不合理的是( )
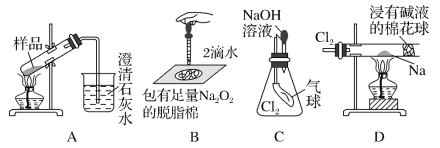
A.鉴别纯碱与小苏打 B.证明Na2O2与水反应放热
C.证明Cl2能与烧碱溶液反应 D.探究钠与Cl2反应
难度: 简单查看答案及解析
-
向含有Mg2+、Fe2+、Cu2+、Al3+的溶液中,加入过量的NaOH溶液,加热并搅拌,再加入过量盐酸,溶液中减少的阳离子是( )
A.Cu2+ B.Mg2+ C.Fe2+ D.Al3+
难度: 中等查看答案及解析
-
下列各项操作中,会产生“先沉淀后溶解”现象的是
A.向
溶液中通入过量
B.向
溶液中加入足量金属钠
C.向
溶液中滴入过量盐酸 D.向沸水中滴加饱和
溶液
难度: 中等查看答案及解析
-
下列操作或实验现象的解释(方程式)正确的是
A.除去Na2CO3溶液中的Na2SO4,加入适量Ba(OH)2溶液后,过滤:Ba2++
=BaSO4↓
B.向AgCl悬浊液中滴加Na2S溶液,白色沉淀变成黑色:2AgCl+S2−=Ag2S↓+2Cl−
C.Na2O2在潮湿的空气中放置一段时间,变成白色黏稠物:2Na2O2+2CO2=2Na2CO3+O2
D.向NaHCO3溶液中加入过量的澄清石灰水,出现白色沉淀: 2
+Ca2++2OH−=CaCO3↓+
+2H2O
难度: 中等查看答案及解析
-
向100 mL NaOH溶液中通入一定量的CO2气体,充分反应后,再向所得溶液中逐滴加入0.2 mol·L-1的盐酸,产生CO2的体积与所加盐酸体积之间关系如图所示。
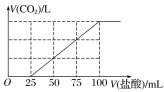
下列判断正确的是( )
A.原NaOH溶液的浓度为0.2 mol·L-1
B.通入CO2在标准状况下的体积为448 mL
C.所得溶液的溶质成分的物质的量之比为n(NaOH)∶n(Na2CO3)=1∶3
D.所得溶液的溶质成分的物质的量之比为n(NaHCO3)∶n(Na2CO3)=1∶1
难度: 中等查看答案及解析
-
将足量的CO2不断通入KOH、Ba(OH)2、KAlO2的混合溶液中,生成沉淀与通入CO2的量的关系可表示为
A.
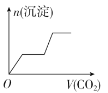 B.
B.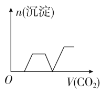 C.
C.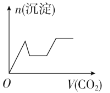 D.
D.难度: 中等查看答案及解析
-
现有25mL2mol·L-1的Na2CO3溶液和75mL1mol·L-1的稀盐酸。(1)将Na2CO3溶液逐滴入稀盐酸中;(2)将稀盐酸逐滴滴入Na2CO3溶液中。两操作的现象及结果(标准状况下)为
A.现象相同,所得气体的体积相等 B.现象不同,所得气体的体积不等
C.现象不同,所得气体的体积相等 D.现象相同,所得气体的体积不等
难度: 中等查看答案及解析
-
镁铝合金5.1 g溶于300 mL2 mol·L-1盐酸中,标准状况下放出气体的体积为5.6 L,向反应后的溶液中加入500 mLNaOH溶液充分反应,最终产生白色沉淀。下列有关说法不正确的是
A.5.1 g镁铝合金中含有镁、铝的质量分别为2.4 g、2.7 g
B.溶解5.1 g镁铝合金时,剩余盐酸中溶质的物质的量为0.1 mol
C.若白色沉淀只有Mg(OH)2,该NaOH溶液的物质的量浓度至少为1.2 mol·L-1
D.生成白色沉淀的最大质量为13.6 g
难度: 中等查看答案及解析