-
化学,就在身旁。下列说法错误的是
A.常见医用口罩的过滤层主要材质是聚丙烯,其结构简式为
B.气溶胶是固态或液态颗粒分散在气体介质中所形成的分散系
C.为了防止蛋白质变性,疫苗等生物制剂要冷冻保藏
D.中医经典方剂“清肺排毒汤”,其处方组成中的生石膏化学式为CaSO4·2H2O
难度: 简单查看答案及解析
-
医用酒精和84消毒液混合使用可能发生反应:4NaClO+CH3CH2OH
HCCl3+HCOONa+NaCl+2NaOH+H2O,设NA为阿伏加德罗常数,下列叙述正确的是
A.含NA个ClO-的NaClO溶液中,Na+数目为NA
B.上述反应中,每生成1molNaCl,转移的电子数为8NA
C.100 g质量分数为46%的乙醇溶液中所含的氢原子数为6NA
D.标准状况下,2.24 L HCCl3含有的共用电子对的数目为0.4NA
难度: 中等查看答案及解析
-
现在正是全球抗击新冠病毒的关键时期,专家指出磷酸氯喹对治疗新冠病毒感染有明显效果,磷酸氯喹的分子结构如图所示,下列关于该有机物的说法正确的是( )
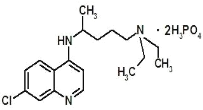
A.该有机物的分子式为:C18H30N3O8P2Cl
B.该有机物能够发生加成反应、取代反应、不能发生氧化反应
C.该有机物苯环上的1-溴代物只有2种
D.1mol该有机物最多能和8molNaOH发生反应
难度: 中等查看答案及解析
-
短周期主族元素X、Y、Z、W的原子序数依次增大,其中只有一种金属元素,它们对应的单质和它们之间形成的常见二元化合物中,有三种有色物质能与水发生氧化还原反应且水没有电子的得失,下列说法正确的是( )
A.简单离子半径:r(W)>r(Z)>r(Y)>r(X)
B.最简单气态氢化物的稳定性:X>Y
C.W形成的含氧酸是强酸
D.Z、Y形成的某种化合物中含有共价键且在熔融状态下能导电
难度: 中等查看答案及解析
-
常温下,下列各组离子在溶液中一定能大量共存的是( )
A.无色溶液中:H+、Fe2+、Cl-、SO
、K+
B.K+、Na+、NO
、Cl-
C.Na+、Al3+、OH-、NO
D.pH=13的溶液:Na+、K+、Cl-、HCO
难度: 简单查看答案及解析
-
Mg–AgCl电池是一种以海水为电解质溶液的水激活电池。如图用该水激活电池为电源电解NaCl溶液的实验中,X电极上有无色气体逸出。下列有关分析正确的是
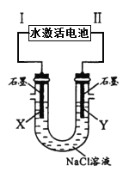
A. II为正极,其反应式为Ag+ + e– =Ag
B. 水激活电池内Cl–由正极向负极迁移
C. 每转移1 mole-,U型管中消耗0. 5mol H2O
D. 开始时U型管中Y极附近pH逐渐增大
难度: 中等查看答案及解析
-
H3AsO4水溶液中含砷的各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH的关系如下图所示(已知pKa=-lgKa),下列说法正确的是
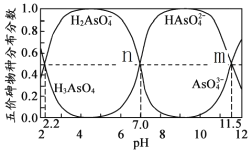
A.H3AsO4溶液pKa2为4.5
B.NaH2AsO4溶液显碱性
C.常温下,m点对应溶液中由水电离出的OH—浓度为10—11.5 mol/L
D.n点对应溶液中,离子浓度关系:c(HAsO42—)=c(H2AsO4—)>c( OH—) =c(H+)
难度: 困难查看答案及解析

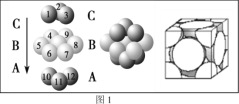
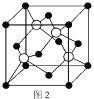
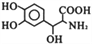 )是一种抗帕金森氏病药物。以下是屈昔多巴的一种合成路线(
)是一种抗帕金森氏病药物。以下是屈昔多巴的一种合成路线( 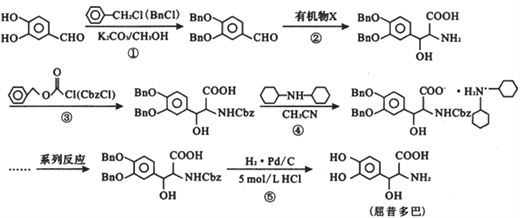
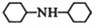 显________性(填“酸”、“中”或“碱”)。
显________性(填“酸”、“中”或“碱”)。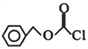 的同分异构体中,能与NaHCO3溶液反应生成CO2的二取代芳香化合物有_____种,其中核磁共振氢谱为四组峰的结构简式为___________________________。
的同分异构体中,能与NaHCO3溶液反应生成CO2的二取代芳香化合物有_____种,其中核磁共振氢谱为四组峰的结构简式为___________________________。