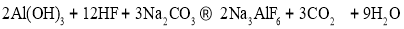-
物质中杂质(括号内为杂质)的检验、除杂的试剂或方法都正确的是
选项
物质及其杂质
检验
除杂
A
Cl2(HCl)
湿润的淀粉KI试纸
饱和食盐水
B
NO(NO2)
观察颜色或湿润的淀粉KI试纸
水
C
CO2(HCl)
AgNO3溶液(含稀硝酸)
饱和Na2CO3溶液
D
NaHCO3溶液(Na2CO3)
Ca(OH)2溶液
过量CO2
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
有关化学资源的合成、利用与开发的叙述合理的是
A.大量使用化肥和农药,能不断提高农作物产量
B.通过有机合成,可以制造出比钢铁更强韧的新型材料
C.安装煤炭燃烧过程的“固硫”装置,主要是为了提高煤的利用率
D.开发利用可燃冰(固态甲烷水合物),有助于海洋生态环境的治理
难度: 简单查看答案及解析
-
对于排布在2s轨道上的电子,不能确定的是
A.电子所在的电子层 B.电子的自旋方向
C.电子云的形状 D.电子云的伸展方向
难度: 中等查看答案及解析
-
能确定为丙烯的化学用语是( )
A.
B.C3H6 C.
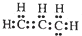 D.CH2=CH-CH3
D.CH2=CH-CH3难度: 简单查看答案及解析
-
下列有关共价键的说法正确的是( )
A.分子晶体中共价键越强,熔沸点越高
B.只含共价键的物质,一定是共价化合物
C.两种元素组成的分子中一定只含有极性共价键
D.分子晶体中,可能不存在共价键,但一定存在分子间作用力
难度: 中等查看答案及解析
-
下列各组物质既不是同系物又不是同分异构体的是( )
A.甲酸甲酯和乙酸 B.对甲基苯酚和苯甲醇
C.油酸甘油酯和乙酸乙酯 D.软脂酸甘油酯和硬脂酸甘油酯
难度: 中等查看答案及解析
-
下列有关物质性质的变化可以用元素周期律解释的是( )
A.酸性:HCl>H2S>H2O B.密度:Na>K>Li
C.沸点:NH3>AsH3>PH3 D.稳定性:HF>HCl>HBr
难度: 中等查看答案及解析
-
NH5属于离子晶体。与水反应的化学方程式为:NH5+H2O→NH3•H2O+H2↑,它也能跟乙醇发生类似的反应,并都产生氢气。有关NH5叙述正确的是( )
A.与乙醇反应时,NH5被氧化
B.NH5中N元素的化合价为+5价
C.1molNH5中含有5molN-H键
D.1molNH5与H2O完全反应,转移电子2mol
难度: 中等查看答案及解析
-
某一化学反应在不同条件下的能量变化曲线如图所示。下列说法正确的是( )
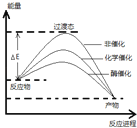
A.化学催化比酶催化的效果好
B.使用不同催化剂可以改变反应的能耗
C.反应物的总能量低于生成物的总能量
D.使用不同催化剂可以改变反应的热效应
难度: 中等查看答案及解析
-
关于Na2O2的叙述正确的是 (NA表示阿伏伽德罗常数)
A.7.8g Na2O2含有的共价键数为0.2NA
B.7.8 g Na2S与Na2O2的混合物, 含离子总数为0.3 NA
C.7.8g Na2O2与足量的CO2充分反应, 转移的电数为0.2NA
D.0.2 mol Na被完全氧化生成7.8g Na2O2, 转移电子的数目为0.4NA
难度: 困难查看答案及解析
-
充分利用已有的数据是解决化学问题方法的重要途径.对数据的利用情况正确的是
A.利用化学平衡常数判断化学反应进行的快慢
B.利用溶解度数据判断氧化还原反应发生的可能性
C.利用沸点数据推测将一些液体混合物分离的可能性
D.利用物质的摩尔质量判断相同状态下不同物质密度的大小
难度: 中等查看答案及解析
-
分析如图装置,下列说法错误的是( )
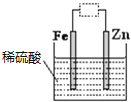
A.虚线框中接直流电源,铁可能会被腐蚀
B.虚线框中接灵敏电流计或接直流电源,锌都是负极
C.虚线框中接灵敏电流计,该装置可将化学能转化为电能
D.若将电解液改成硫酸锌溶液并接上直流电源,该装置可用于铁皮上镀锌
难度: 中等查看答案及解析
-
在化学反应中,有时存在“一种物质过量,另一种物质仍不能完全反应”的情况,下列反应不属于这种情况的是
A.过量的铜与浓硝酸反应
B.过量的铜与浓硫酸在加热条件下反应
C.过量二氧化锰与浓盐酸在加热条件下反应
D.过量的氢气与氮气在工业生产条件下反应
难度: 困难查看答案及解析
-
25℃时将10mLpH=11的氨水加水稀释至100mL,下列判断正确的是
A.稀释后溶液的pH=7 B.氨水的电离度增大,溶液中所有离子的浓度均减小
C.稀释过程中
增大 D.pH = 11氨水的浓度为0.001mol/L
难度: 中等查看答案及解析
-
对已达化学平衡的反应:2X(g)+Y(g)
2Z(g),减小压强后,对反应产生的影响是
A.逆反应速率增大,正反应速率减小,平衡向逆反应方向移动
B.逆反应速率减小,正反应速率增大,平衡向正反应方向移动
C.正反应速率先减小后增大,逆反应速率减小,平衡向逆反应方向移动
D.逆反应速率先减小后增大,正反应速率减小,平衡向逆反应方向移动
难度: 中等查看答案及解析
-
关于下列四个装置的说明符合实验要求的是
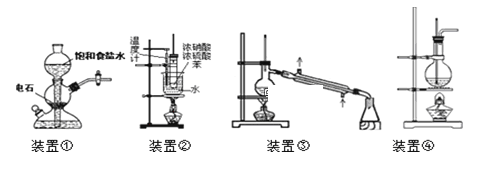
A.装置①:实验室中若需制备较多量的乙炔可用此装置
B.装置②:实验室中可用此装置来制备硝基苯,但产物中可能会混有苯磺酸
C.装置③:实验室中可用此装置分离含碘的四氯化碳液体,最终在锥形瓶中可获得碘
D.装置④:实验室中可用此装置来制备乙酸乙酯并在烧瓶中获得产物
难度: 中等查看答案及解析
-
向100mL0.1mol∙L-1硫酸铝铵[NH4Al(SO4)2]溶液中逐滴滴入0.1mol∙L-1Ba(OH)2溶液。随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化如图所示。下列说法正确的( )
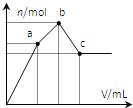
A.a点的溶液呈中性
B.a点沉淀的质量比c点沉淀的质量大
C.b点加入Ba(OH)2溶液的体积为250mL
D.至c点完成反应,反应的离子方程式可表示为:Al3++2SO42-+NH4++2Ba2++5OH-→AlO2-+2BaSO4↓+NH3∙H2O+2H2O
难度: 困难查看答案及解析
-
常温下,向20mL
溶液中滴加
NaOH溶液.有关微粒的物质的量变化如图,下列说法正确的是
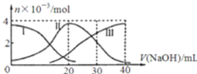
A.滴加过程中当溶液呈中性时,
B.当
时,则有:
C.H
在水中的电离方程式是:H
;
D.当
时,则有:
难度: 中等查看答案及解析
-
6克含杂质的Na2SO3样品与足量盐酸反应,可生成1.12升气体(S、T、P),气体质量为3克,该样品的组成可能是( )
A.Na2SO3,Na2CO3 B.Na2SO3,NaHCO3
C.Na2SO3,NaHCO3,Na2CO3 D.Na2SO3,MgCO3,NaHCO3
难度: 简单查看答案及解析
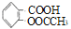 转变为
转变为