-
下列四种溶液中,常温下由水电离出的c(H+)之比(①∶②∶③∶④)等于①pH=0的盐酸 ② 0.1 mol·L-1的盐酸 ③ 0.01 mol·L-1的NaOH溶液 ④pH=11的NaOH溶液
A.1∶10∶100∶1 000 B.0∶1∶12∶11
C.14∶13∶12∶11 D.14∶13∶2∶3
难度: 中等查看答案及解析
-
HA为酸性略强于醋酸的一元弱酸,在0.1 mol·L-1NaA溶液中,离子浓度关系正确的是
A.c(Na+)>c(A-)>c(H+)>c(OH-)
B.c(Na+)>c(OH-)>c(A-)>c(H+)
C.c(Na+)+c(OH-)=c(A-)+c(H+)
D.c(Na+)+ c(H+) = c(A-)+c(OH-)
难度: 简单查看答案及解析
-
下列热化学方程式书写正确的是(ΔH的绝对值均正确)( )
A.C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(g) ΔH=-1367.0kJ·mol-1(燃烧热)
B.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) ΔH=+57.3kJ·mol-1(中和热)
C.S(s)+O2(g)=SO2(g) ΔH=-296.8kJ·mol-1(反应热)
D.2NO2=O2+2NO ΔH=+116.2kJ·mol-1(反应热)
难度: 中等查看答案及解析
-
X、Y、Z、W四块金属分别用导线两两相连浸入稀硫酸中组成原电池,X、Y相连时,X为负极;Z、W相连时,电流方向是W→Z;X、Z相连时,Z极上产生大量气泡;W、Y相连时,W极发生氧化反应。据此判断金属的活动性顺序是
A.Y>W>Z>X B.X>Z>W>Y C.Z>X>Y>W D.X>Y>Z>W
难度: 中等查看答案及解析
-
下列能量转化过程与氧化还原反应无关的是( )
A.
 硅太阳能电池
硅太阳能电池B.
 锂离子电池放电
锂离子电池放电C.
 火箭的燃料燃烧
火箭的燃料燃烧D.
 葡萄糖提供能量
葡萄糖提供能量难度: 简单查看答案及解析
-
已知等浓度的NaX、NaY 、NaZ三种溶液的pH:10、9、8,则由此可判断下列叙述正确的是( )
A.HX > HY > HZ B.HX < HY < HZ
C.HZ > HX > HY D.HX > HZ > HY
难度: 简单查看答案及解析
-
某科研团队研制出“TM﹣LiH(TM表示过渡金属)”双催化剂体系,显著提高了在温和条件下氮气和氢气合成NH3的效率,原理示意如下:
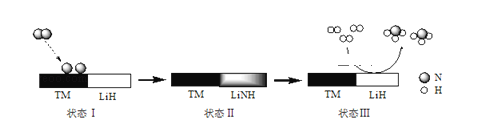
下列分析不合理的是( )
A.状态Ⅰ,吸收能量并有N≡N键发生断裂 B.合成NH3总反应的原子利用率是100%
C.“TM﹣LiH”能降低合成氨反应的△H D.生成NH3:2LiNH+3H2═2LiH+2NH3
难度: 中等查看答案及解析
-
下列叙述中正确的是
A. 若在海轮外壳上附着一些铜块,则可以减缓海轮外壳的腐蚀
B. 常温常压下,氢氧燃料电池放电过程中消耗11.2 L H2,转移电子的数目为6.02×1023
C. 工业制粗硅2C(s)+SiO2(s)===Si(s)+2CO(g),室温下不能自发进行,则△H>0
D. 稀盐酸和稀氢氧化钠反应的中和热为-57.3 kJ•mol-1,则稀醋酸和稀氨水反应的中和热也为-57.3kJ·mol-1
难度: 困难查看答案及解析
-
反应A(g)+2B(g)C(g)+D(g)+QkJ的能量变化如图所示,有关叙述正确的是
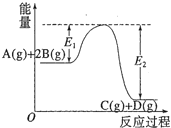
A.Q=E2
B.在反应体系中加入催化剂,反应速率增大,E1减小,E2不变
C.Q>0,升高温度,正反应速率增大,逆反应速率减小
D.若减小体积,平衡会移动,当反应再次达到平衡时,A的平衡浓度增大
难度: 中等查看答案及解析
-
下列用来表示物质变化的化学用语中,正确的是( )
A.电解饱和食盐水:C1-+2H2O
H2↑+Cl2↑+OH-
B.铅蓄电池充电时阳极反应式为:PbSO4–2e-+2H2O=PbO2+4H++SO42―
C.氢氧燃料电池在碱性介质中的负极反应式:O2+2H2O+4e-=4OH-
D.钢铁发生电化学腐蚀的正极反应式:Fe–2e-=Fe2+
难度: 中等查看答案及解析
-
已知:CO2(g)+3H2(g)
CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1。一定条件下,向体积为1 L的密闭容器中充入1 mol CO2和3 mol H2,测得CO2和CH3OH(g)的浓度随时间的变化曲线如图所示。下列叙述中正确的是( )
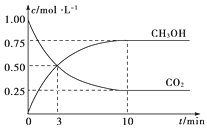
A.欲增大平衡状态时
的比值,可采用升高温度的方法
B.3 min时,CO2的消耗速率等于CH3OH的生成速率,且二者浓度相同
C.欲提高H2的平衡转化率只能加压减小反应容器的体积
D.从反应开始到平衡,H2的平均反应速率v(H2)=0.075 mol·L-1·min-
难度: 中等查看答案及解析
-
NA表示阿伏加德罗常数的值,下列说法正确的是( )
A.将1mol Cl2通入水中,HClO、Cl-、ClO-粒子数之和为
B.密闭容器中2molNO与1molO2充分反应,产物的分子数为2NA
C.1L 0.1mol·L-1的NaHCO3溶液中HCO3-和CO32-离子数之和为0.1NA
D.某电池的总反应为Fe+2Fe3+=3Fe2+,当有5.6gFe溶解时电路中有0.2mol e-通过
难度: 中等查看答案及解析
-
下列各种情况下能大量共存的离子组为( )
A.pH=7的溶液中:Fe3+、Cl-、Na+、NO3-
B.c(H+)=1×10-3mol/L的溶液中Na+、CO32-、Cl-、K+
C.pH=1的溶液中NH4+、Cl-、Mg2+、SO42-
D.Al3+、HCO3-、I-、Ca2+
难度: 中等查看答案及解析
-
铜锌原电池(如图)工作时,下列叙述正确的是
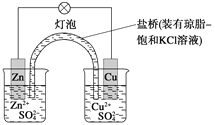
A.正极反应为:Zn-2e-===Zn2+
B.电池反应为:Zn+Cu2+===Zn2++Cu
C.在外电路中,电子从正极流向负极
D.盐桥中的K+移向ZnSO4溶液
难度: 简单查看答案及解析
-
在一定条件下,Na2CO3溶液存在水解平衡:CO32-+H2O
HCO3-+OH-,下列说法正确的是( )
A.稀释溶液,水解平衡常数增大 B.通入CO2,平衡朝正反应方向移动
C.升高温度,
减小 D.加入NaOH固体,溶液pH减小
难度: 中等查看答案及解析
-
下列图示与对应的叙述不正确的是( )
A.
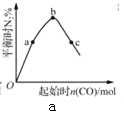 表示反应4CO(g)+2NO2(g)⇌N2(g)+4CO2(g),保持其他条件不变,改变CO的物质的量,平衡时N2的体积分数变化情况。由图可知,NO2的转化率:c>b>a
表示反应4CO(g)+2NO2(g)⇌N2(g)+4CO2(g),保持其他条件不变,改变CO的物质的量,平衡时N2的体积分数变化情况。由图可知,NO2的转化率:c>b>aB.
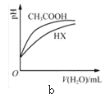 b表示25℃时,分别加水稀释体积均为100 mL、pH=2的CH3COOH溶液和HX溶液,则25℃时HX的电离平衡常数小于CH3COOH的电离平衡常数
b表示25℃时,分别加水稀释体积均为100 mL、pH=2的CH3COOH溶液和HX溶液,则25℃时HX的电离平衡常数小于CH3COOH的电离平衡常数C.
 c是一定条件下,向含有一定量A的容器中逐渐加入B时的图象,压强p1 > p2
c是一定条件下,向含有一定量A的容器中逐渐加入B时的图象,压强p1 > p2D.
 d是在平衡体系的溶液中溶入少量KCl固体后化学反应速率随时间变化的图象
d是在平衡体系的溶液中溶入少量KCl固体后化学反应速率随时间变化的图象难度: 中等查看答案及解析
-
对下列现象或事实的解释正确的是( )
选项
现象或事实
解释
A
用热的纯碱溶液去除油污
纯碱与油污直接发生反应,生成易溶于水的物质
B
施肥时,草木灰(有效成分为K2CO3)不能与NH4Cl混合使用
K2CO3与NH4Cl反应生成氨气会降低肥效
C
漂白粉在空气中久置变质
漂白粉中的ClO-可以水解成HClO
D
FeCl3溶液可用于水处理
FeCl3中Fe3+具有氧化性可杀菌消毒
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
下列说法不正确的是( )
A.常温下,将pH=4的盐酸1mL稀释至100 mL后,pH等于6
B.常温下,pH均为3的醋酸和硝酸溶液,醋酸的浓度大于硝酸的浓度
C.常温下,pH为1的硝酸溶液中加入等体积pH为13氢氧化钡溶液恰好完全中和
D.若V1LpH=11的NaOH溶液与V2LpH=3的HA溶液混合后显中性,则V1≤V2
难度: 中等查看答案及解析
-
铁镍蓄电池又称爱迪生电池,放电时的总反应为:Fe+Ni2O3+3H2O
Fe(OH)2+2Ni(OH)2,下列有关该电池的说法不正确的是( )
A.电池放电时,负极反应为Fe+2OH--2e-=Fe(OH)2
B.电池的电解质溶液为碱性溶液,阳离子向正极移动
C.电池充电过程中,阴极附近溶液的pH降低
D.电池充电时,阳极反应为2Ni(OH)2+2OH--2e-=Ni2O3+3H2O
难度: 中等查看答案及解析
-
常温时,向20mL 0.1 mol/L的CH3COOH溶液中逐滴滴加0.1 mol/L的NaOH溶液,滴入NaOH溶液的体积与溶液pH的变化如图所示。下列说法正确的是
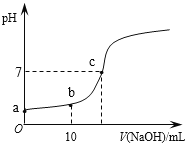
A. a点的pH=1
B. b点时,c (CH3COO—)=0.05mol/L
C. c点时,V(NaOH)=20mL
D. 反应过程中
的值不断增大
难度: 困难查看答案及解析