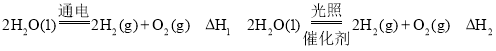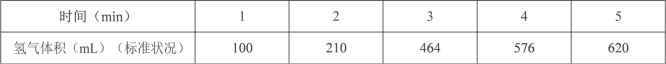-
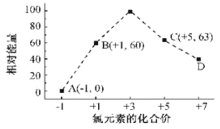
不能说明氯元素的非金属性比硫元素强的事实是( )
A. Cl2与H2S溶液发生置换反应
B. 受热时H2S能分解,HCl则不能
C. 硫和Cl2分别与氢气化合时, Cl2比硫更容易
D. 溶于水时HCl是强酸,H2S是弱酸
难度: 中等查看答案及解析
-
下列有关电池的说法不正确的是
A. 手机上用的锂离子电池属于二次电池
B. 铜锌原电池工作时,电子沿外电路从铜电极流向锌电极
C. 甲醇燃料电池可把化学能转化为电能
D. 锌锰干电池中,锌电极是负极
难度: 中等查看答案及解析
-
下列有关元素及其化合物性质的比较正确的是( )
A.原子半径:F<O<Al B.稳定性:H2O<PH3<NH3
C.酸性:H2CO3<H2SO4<H3PO4 D.碱性:LiOH<NaOH<Al(OH)3
难度: 中等查看答案及解析
-
下列有关化学用语表示正确的是( )
A.H2O2的电子式:H+[
]2-H+ B.Cl-的结构示意图:
C.原子核中有10个中子的氧离子:188O2— D.HClO的结构式H-Cl-O
难度: 简单查看答案及解析
-
若N60是与C60相似的另一种“分子足球”,下列说法正确的是
A. N60分子中只含有共价键 B. N60和14N都是氮的同位素
C. N60是一种新型化合物 D. N60与N2互为同分异构体
难度: 中等查看答案及解析
-
能源是当今社会发展的三大支柱之一。有专家提出:如果能够利用太阳能使燃料燃烧产物,如 CO2、H2O、N2 等重新组合(如图),可以节约燃料,缓解能源危机。在此构想的物质循环中太阳能最终转化为( )
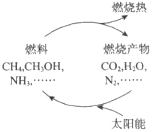
A.化学能 B.热能 C.生物能 D.电能
难度: 简单查看答案及解析
-
下列关于元素周期表的说法不正确的是( )
A.每个主族元素中都有非金属元素 B.周期表中 0 族不含有金属元素
C.副族和第Ⅷ族元素都是金属元素 D.长周期元素中也含有非金属元素 117 号元素为Ts
难度: 简单查看答案及解析
-
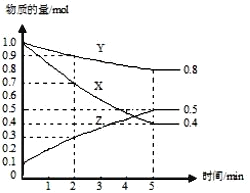
位于元素周期表氟元素同一族。下列说法错误的是( )
A.Ts 是主族元素 B.Ts 的最外层有 7 个电子
C.Ts 原子核外共有 6 个电子层 D.同族元素中 Ts 非金属性最弱
难度: 简单查看答案及解析
-
下列说法正确的是( )
A.氢氧燃料电池放电时化学能全部转化为电能
B.需高温条件进行的反应均为吸热反应
C.2 mol SO2 与 1 mol O2 混合反应,生成的 SO3 一定小于 2 mol
D.由分子组成的物质中一定含有共价键
难度: 中等查看答案及解析
-
将 N2、H2 的混合气体分别充入甲、乙、丙三个容器中,进行合成氨反应,经过相同的一段时间后,测得反应速率分别为:甲:v(H2)=1 mol·L-1·min-1;乙:v(N2)=2 mol·L-1·min-1;丙:v(NH3)=3 mol·L-1·min-1。则三个容器中合成氨的反应速率( )
A.v(甲)>v(乙)>v(丙) B.v(乙)>v(丙)>v(甲)
C.v (丙)>v(甲)>v(乙) D.v(乙)>v(甲)>v(丙)
难度: 简单查看答案及解析
-
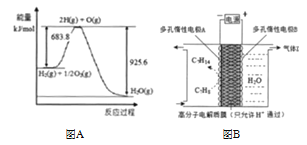
下列能正确表示氢气与氯气反应生成氯化氢过程中能量变化的示意图是
A.
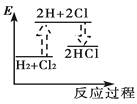 B.
B. 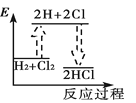 C.
C. 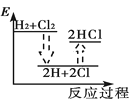 D.
D. 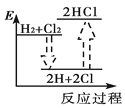
难度: 中等查看答案及解析
-
植物及其废弃物可以制取乙醇燃料,下列关于乙醇燃料的说法错误的是( )
A.它是一种再生能源 B.乙醇易燃烧,污染小
C.乙醇只能在实验室内作燃料 D.粮食作物是制乙醇的重要原料
难度: 简单查看答案及解析
-
下列有关化学键的说法中错误的是
A. 氯化钠熔化或氯化氢溶于水时都要破坏化学键
B. 离子化合物中可能含有共价键,共价化合物中一定不含有离子键
C. 氯化铵受热变成气体,冷却后又成晶体,此过程中化学键没有发生变化
D. 碘晶体升华和冰融化时都未涉及化学键的变化
难度: 中等查看答案及解析
-
已知空气—锌电池的电极反应如下:锌片电极:2Zn + 4OH- - 4e- = 2ZnO + 2H2O 石墨电极:O2 + 2H2O + 4e- = 4OH-,下列说法正确的是( )
A.电流从锌片沿导线到石墨 B.锌片作正极,发生氧化反应
C.溶液中阴离子往石墨电极移动 D.石墨作正极,发生还原反应
难度: 简单查看答案及解析
-
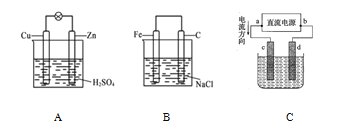
某研究性学习小组为了证明铁的金属性比铜强,他们设计了如下几种方案,合理的是( )
A.铁、铜与氯气反应分别生成 FeCl3、CuCl2
B.足量的铁粉和铜粉与浓硫酸在加热的条件下反应分别生成 FeSO4 和 CuSO4
C.将铜片置于 FeCl3 溶液中铜片逐渐溶解
D.铁片、铜片分别置于盛有稀硫酸的烧杯中,并用导线连接,铁片上有气泡产生,而铜片上有气泡产生
难度: 中等查看答案及解析
-
氮氧化铝(AlON)是一种透明高硬度防弹材料,硬度为石英玻璃的 4 倍,可耐 120 摄氏度的高温。下列描述错误的是( )
A.AlON 和石英的化学键类型相同 B.AlON 和石英晶体类型相同
C.AlON 和 NaCl 的化学键类型不同 D.AlON 和 NaCl 晶体类型相同
难度: 中等查看答案及解析
-
X、Y、Z、Q、W均为短周期主族元素,原子序数依次增大,X、Y是组成空气的主要元素,Y2-与Z+核外电子排布相同,Q的原子序数为Y的2倍。下列说法正确的是
A.X、Y组成的原子个数比为1:1和1:2的两种化合物均是共价化合物
B.Y和Z可组成阴阳离子个数比为1:1和1:2的两种物质
C.Y、Q的简单氢化物的热稳定性:Q>Y
D.X、Q、W最高价氧化物对应的水化物的酸性:X>W>Q
难度: 中等查看答案及解析
-
下列条件一定能使反应速率加快的是( )
①增加反应物的物质的量;②升高温度;③缩小反应容器的体积;④加入 MnO2
A.全部 B.①②④ C.② D.②③
难度: 简单查看答案及解析
-
已知充分燃烧a g乙炔气体时生成1mol二氧化碳气体和液态水,并放出热量b kJ,则乙炔燃烧的热化学方程式正确的是
A.
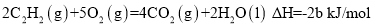
B.
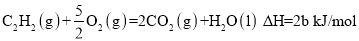
C.
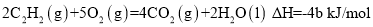
D.
难度: 简单查看答案及解析
-
化合物Bilirubin在一定波长的光照射下发生分解反应,反应物浓度
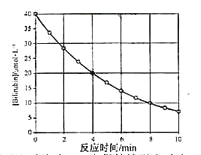
随反应时间变化如右图所示,计算反应4~8min间的平均反应速率和推测反应16min时反应物的浓度,结果应是
A.2.5μmol·L-1·min-1和2.0 μmol·L-1
B.2.5μmol·L-1·min-1和2.5 μmol·L-1
C.3.0μmol·L-1·min-1和3.0 μmol·L-1
D.5.0μmol·L-1·min-1和3.0 μmol·L-1
难度: 中等查看答案及解析
-
在恒温恒容的密闭容器中,加入1 molN2和3molH2使其充分反应:N2(g)+3H2(g)
2NH3(g) ΔH=-92.4kJ·mol-1,则该反应释放的热量为( )
A. 等于92.4kJ B. 小于92.4kJ
C. 大于92.4kJ D. 无法确定
难度: 简单查看答案及解析
-
由质量均为 10 g 的铁片﹑铜片和足量的 CuSO4 溶液组成原电池装置,经过一段时间后,两电极的质量差变为 12 g,则下列说法正确的是( )
A.铁片溶解了 12 g B.导线中通过了 0.2 mol 电子
C.铜片上析出了 6 g Cu D.铜片溶解了 6.4 g
难度: 中等查看答案及解析
-
氢氧燃料电池用于航天飞船,电极反应产生的水经冷凝后可作为航天员的饮用水,其电极反应如下:
负极:2H2 + 4OH--4e-= 4H2O
正极:O2 + 2H2O + 4e-= 4OH-
当得到1.8L饮用水时,电池内转移的电子数约为( )。
A.1.8 mol B.3.6 mol C.100 mol D.200 mol
难度: 中等查看答案及解析